NSAID 胃炎は、プロスタグランジンを合成する多くの組織に常に存在するシクロオキシゲナーゼ-1 アイソザイム (COX-1) の抑制に関連しており、特定の細胞の正常な活動を調節し、それによって胃腸管 (GIT) 粘膜、血管の細胞保護を提供します。止血と腎機能。 COX-2アイソザイムは炎症の病巣でのみ発現しますが、 , 炎症性プロスタグランジンの過剰な形成を決定します。 NSAID の有効性と安全性は、COX-2 の選択的抑制と関連しています。 したがって、COX-1 活性をより強力に抑制する NSAID (例えば、アセチルサリチル酸) は、COX-2 をより抑制したり、両方の COX (ジクロフェナク ナトリウム) に対して同等の効果を持つ薬物よりも頻繁に胃腸管に損傷を与えます。 -COX-1 (イブプロフェン) に対する依存効果。 NSAID を服用した場合に胃腸合併症を発症する相対リスクの最初の臨床メタ分析の 1 つは、D. Henry らによって実施されました。 (1993)、患者の入院を引き起こした10,000を超える重篤な反応を研究しました。 インドメタシン、ピロキシカム、ケトプロフェンの治療では、イブプロフェンを服用したときに胃腸毒性を発症するリスクが最も低くなりました。 興味深いことに、この分析では消化管毒性の用量依存的影響も調べましたが、繰り返しますが、イブプロフェンの臨床的に有効な用量は最も低いリスクと関連していました. NSAIDs の作用機序の研究が、副作用のほとんどない新薬の創出への強力な原動力となったことは特に重要です。 その中で、これまでのところ最も研究されているのは、主に選択的な COX-2 阻害剤 (メロキシカム、ニメスリド) です。
処理。消化器系の副作用の危険因子がある患者には、すぐに COX-2 阻害剤を処方することをお勧めします。 それらの使用の適応症の拡大は、現在、主に「標準的な」NSAIDs と比較してこれらの薬のコストが高いことに関連する「薬剤経済学的」な考慮事項によって制限されています。 胃腸管の潰瘍性病変の発症に伴い、理想的には、NSAIDを中止する必要があります。これにより、抗潰瘍療法の有効性が高まり、潰瘍性びらんプロセスの再発のリスクが軽減されます。 軽度の痛みがある患者では、パラセタモールに切り替えることができます。 ただし、有効量(約4 g /日)では、パラセタモールは胃腸管や他の臓器からの合併症の発生という点でも安全ではありません. パラセタモールが有効であることが知られていない中等度から重度の疼痛を有する患者では、ジクロフェナクとミソプロストールの併用、特に「標準」の NSAID よりも有効性が劣らない COX-2 阻害剤の使用がより正当化されます。 . 抗潰瘍治療の最適な戦術を選択するという問題は、広く研究されています。 現在、H2-ヒスタミン受容体遮断薬 (効率が低いため) やミソプロストール (忍容性が低いため) にほぼ完全に取って代わったプロトンポンプ阻害薬が最適な薬であることは間違いありません。 さらに、NSAID を最初に服用し始めた患者に対する現在の推奨事項によると、根絶は ピロリ菌さらなる治療中の潰瘍性出血のリスクを軽減するのに役立ちます。 再発性潰瘍出血のリスクが非常に高い患者を管理する戦術の問題は、未解決のままです。
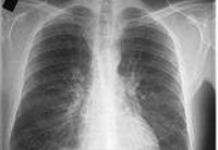
図 3. 抗血小板療法中の胃障害。
最近では、これらの患者において、セレコキシブによる治療は、ジクロフェナクを継続しながらオメプラゾールによる治療と同様に再発性胃出血の予防に有効であることが示されています。 しかし、これらの患者は、治療後 6 か月以内に再出血のリスクがかなり高いままでした (それぞれ 4.9% と 6.4%)。 これにより、基本的に重要な 2 つの結論を導き出すことができます。 第一に、COX-2 阻害剤は「標準的な」NSAID と比較して安全性が高く、重度の胃腸の副作用のリスクがある患者においても安全です。 第二に、COX-2阻害剤が特定のカテゴリーの患者における重度の合併症のリスクを完全に排除できないことについて. これらの患者に対する最適な治療法は、COX-2阻害剤とプロトンポンプ阻害剤の併用であると考えられます。
COX-2 とアスピリンを心臓病量で併用するなどの NSAID の使用は、潰瘍性合併症のリスクを大幅に高めるため、胃保護療法を処方する必要があります。
心臓予防のための低用量アスピリンの使用は、上部消化管合併症のリスクの 2 倍から 4 倍の増加と関連しています。 コーティングされたアスピリンを使用しても、出血のリスクは減りません。 合併症のリスクは、アスピリンの用量が 81 mg を超えると増加します。
アスピリンと抗凝固薬(ヘパリン、低分子量ヘパリン、ワルファリン)の併用は、主に上部消化管からの主要な頭蓋外出血のリスクの臨床的に重要な増加と関連しています。 この組み合わせを使用する場合、PPI の必須の任命が必要です。
ワルファリン、アスピリン、クロピドグレルを併用する場合、INR は 2 ~ 2.5 が推奨されます。
クロピドグレルとワルファリンの組み合わせは、両方の単剤療法がそうでない場合、大出血の増加と関連しています. 抗血小板療法と抗凝固療法の併用は、陽性点と陰性点が優勢な場合にのみ使用する必要があります。
プロトンポンプ阻害薬は、NSAIDs およびアスピリンによって引き起こされる胃腸合併症の治療と予防に適応されます。
摂取によって引き起こされる胃腸管のびらん性および潰瘍性病変は、深刻な医学的および社会的問題を表しています。 これらには、消化管の上部の粘膜が損傷しているNSAID胃炎が含まれます。
統計によると、毎日、世界中の NSAIDs は 3,000 万人を超える多数の人々によって服用されていますが、これらの数字は信頼できるとは言えません。どこにも考慮されていません。
人々は計画的に NSAIDs を服用しており、約 70% を占めています。 あまり一般的ではありませんが、これらの薬は、およびその他の慢性疼痛症候群に対して処方されます。
素因
NSAIDsの服用に関連する胃障害を発症するリスクは、65歳以上の人々で劇的に増加します.抗炎症活性を有する薬物の体系的な使用による胃十二指腸損傷の有病率は非常に高いです。 この場合、胃障害を発症するリスクはほぼ4倍になり、リスクは9倍になります。 胃内視鏡検査では、NSAID を服用している患者の 50% でびらんおよび潰瘍性欠陥が検出されます。
ただし、NSAID 胃障害はすべての患者に発生するわけではありません。 健康に大きな害を与えることなく、このグループの薬を長期間服用できる人もいれば、逆に、抗炎症薬を低用量で短期間でも使用すると、消化管のびらん性および潰瘍性病変。 したがって、臨床診療では、要因が区別され、患者に存在すると胃障害を発症するリスクが高まります。
- 高齢者(65歳以上)。
- 以前に転送されました。
- 随伴疾患(など)。
- 喫煙。
- 同時受信、細胞増殖抑制剤。
- 高用量のNSAIDまたはこのグループの薬剤の組み合わせによる長期治療。
開発メカニズム
NSAID胃障害の直接の原因は、このグループの薬が胃腸管の粘膜に及ぼす悪影響です。
NSAIDs の損傷作用の主なメカニズムは、酵素シクロオキシゲナーゼの遮断です。 この酵素には COX1 と COX2 の 2 つの異性体があることに注意してください。 NSAIDの副作用が関連しているのは、それらの最初のものです。
- COX2 の遮断は、リウマチ学および神経学におけるこれらの薬物の使用の基礎となる抗炎症および鎮痛効果を引き起こします。
- COX1分泌の抑制は、粘膜におけるプロスタグランジンの合成の減少につながり、それは胃液の攻撃性の増加と局所保護因子の弱体化につながります。
NSAIDs を長期間使用すると、脂質過酸化が活性化され、組織内にフリーラジカルが蓄積され、一酸化窒素の合成が抑制されます。これは、胃障害の発症にも重要な役割を果たします。
臨床症状
ほとんどの場合、NSAID によって引き起こされる胃または十二指腸のびらんおよび潰瘍は、無症候性または乏症です。 これは、そのような薬の鎮痛効果と抗炎症効果によるものです。 患者の一部のみが医療の助けを求め、次のことを訴えます。
- げっぷ
- 、時々嘔吐;
- 膨満;
- 食欲減少;
- 排便回数の変化 ( または )。
この病状の無症候性形態は、多くの場合、消化管出血の診療所から現れます。 彼らはコーヒーかすと黒い便を吐きます。 これには、低酸素症を伴う血行動態障害と重要臓器への血液供給障害が伴います。 さらに、そのような患者はしばしば遅れて医療援助を求め、出血を背景にNSAIDを服用し続け、状況をさらに悪化させます.
NSAID胃障害の潜在的な経過のもう1つの深刻な合併症は、急性の発症を伴う潰瘍の穿孔です。
診断
 胃内視鏡検査は、NSAID の使用に関連するものを含め、あらゆる原因の胃障害を診断するための主要な方法です。
胃内視鏡検査は、NSAID の使用に関連するものを含め、あらゆる原因の胃障害を診断するための主要な方法です。 NSAID胃炎の診断において、それは特別な場所を占めています. 食道、胃、十二指腸の粘膜を検査し、そこでの病理学的変化を特定できるのは、この診断方法です。
- 充血および浮腫;
- 点状出血、びらんまたは潰瘍の存在。
この病状の無症候性経過の可能性を考えると、長期間NSAIDを服用し、危険因子を持つすべての患者に対して、少なくとも6か月に1回(必要に応じてより頻繁に)胃鏡検査を実施する必要があります。
胃または十二指腸の粘膜の欠陥の特定には、以下の鑑別診断が必要です。
- 消化性潰瘍;
- 一次潰瘍形態。
同時に、苦情の性質と重症度、病気の病歴、および客観的な検査のデータが考慮されます。 診断を明確にするために、腹部臓器の超音波検査、コンピューター、または追加で処方することができます。
処理
NSAID 胃炎の治療の主な方向性は次のとおりです。
- 潰瘍形成薬の中止(可能であれば)または別のより安全な薬との交換。
- 潰瘍性欠陥の治癒と病理学的症状の除去を促進する薬の任命。
まず第一に、非ステロイド系抗炎症薬のグループから薬を処方するとき、医師は患者に対する安全性を考慮し、胃粘膜への影響が最小限であるか、または胃粘膜に影響を与えない薬を優先します。それはまったく。 そのような薬には以下が含まれます:
- 選択的COX-2阻害剤(ニメスリド、メロキシカム);
- 高度に選択的な COX-2 ブロッカー (すべてのコキシブ)。
治療をキャンセルできない場合、NSAID胃炎の患者に処方されるのはこれらの薬です。
びらん性および潰瘍性病変を排除するために、次の薬が使用されます。
- プロスタグランジンの合成類似体(ミソプロストール、エンプロスチル)。
- 現代の抗分泌剤: (オメプラゾール、ラベプラゾール、ランソプラゾール、パントプラゾール、エソメプラゾール) および H2-ヒスタミン受容体遮断薬 (ラニチジン、ファモチジン)。
さらに、胃保護剤(De-nol、Sukrat-gel)およびエンベロープ剤(Almagel、Phosphalugel)を処方することができます。
治療期間は個別に決定されますが、少なくとも4週間です。
この問題を解決するための有望な方向性は、一酸化窒素供与体が豊富な NSAIDs の合成であり、これらの薬物の潰瘍形成効果を防ぐはずです。 そのような薬はすでに存在します。 その有効性と安全性に関する研究が進行中です。
NSAID胃炎を予防する方法
NSAID 胃炎の予防方法の開発は、医学の重要な分野です。 この状態を予防するか、少なくともその発症リスクを軽減することは可能です。 薬物誘発性の胃障害を予防するための主な指示は次のとおりです。
- NSAIDのグループからの選択的および高度に選択的な薬物の使用。
- 最小有効用量でのこれらの薬の指定、および可能であれば短いコース。
- このグループの2つ以上の薬の組み合わせを避けてNSAIDを使用する戦術。
- 治療の医学的監督と予定された内視鏡検査。
- 食後の薬の服用。
- NSAIDの剤形の改善:直腸坐剤、非経口投与用の溶液、パッチ(治療の最初の2週間でのみ胃障害を発症するリスクを軽減します)。
- 抗分泌薬による治療の予防コース。
どの医師に連絡するか
患者がアスピリン、ジクロフェナク、イブプロフェンなどに基づく薬を長期間服用している場合は、定期的に一般開業医または胃腸科医を訪問する必要があります。 必要に応じて、そのような患者は線維胃十二指腸鏡検査 (FGDS) を受けます。
非ステロイド性抗炎症薬 (NSAIDs) は、臨床現場で最も一般的に使用されている薬の 1 つです。 同時に、主な適応症に対する高い薬物療法効果とともに、あらゆる範囲の合併症がNSAIDの使用に関連しています。 特に重要なのは、軽度の消化不良またはびらん、消化性潰瘍、および出血の発生によって現れる、胃腸粘膜に対する NSAIDs の負の特異的効果です。 公開されている診療ガイドラインは、NSAID を使用する際に胃腸障害を発症するリスクを軽減することを目的としており、臨床医が特定の臨床症例における NSAID 胃障害の薬の選択、予防の必要性、および治療の原則に関して十分な情報に基づいた決定を下すことを可能にします。 有害事象の数が最も少ない選択的 NSAID の指定に加えて、プロトンポンプ阻害剤 (PPI) の使用は、胃障害の予防と治療に適応されます。 パントプラゾール (元の薬である Controloc) は、臨床効果があるだけでなく、薬物相互作用が最小限に抑えられています。 この事実により、パントプラゾールを最も安全な PPI と見なすことができ、過剰摂取の症状や減少のリスクがないことを確認しながら、肝臓で同様の代謝経路を持ついくつかの薬を処方する必要がある場合にそれを優先することができます。これらの薬の効果で。
キーワード:非ステロイド性抗炎症薬 (NSAIDs)、NSAID 胃炎、プロトンポンプ阻害薬、パントプラゾール、Controloc。
引用のために: Balukova E.V. NSAID 誘発性胃障害: 発生メカニズムの理解から、予防と治療のための戦略の開発まで // BC. 2017年第10号。 pp.697-702
NSAID による胃障害:メカニズムの理解から予防および治療戦略の開発まで
Balukova E.V.
最初のSt. I.P. にちなんで名付けられたピーターズバーグ州立医科大学 パブロフ
非ステロイド性抗炎症薬 (NSAIDs) は、臨床現場で最も一般的な薬です。 同時に、主な適応症による高い薬物治療効果とともに、NSAIDsの摂取に関連するさまざまな合併症があります。 NSAIDsが軽度の消化不良またはびらん、消化性潰瘍、出血の発症によって明らかにされる、胃腸管の粘膜に負の特異的影響を与えることが特に重要です。 公開された実用的な推奨事項は、NSAID を使用する際に胃腸障害を発症するリスクを軽減することを目的としており、臨床医が特定の臨床症例における薬剤の選択、予防の必要性、および NSAID の治療の原則に関して十分な情報に基づいた決定を下せるようにすることを目的としています。 胃障害の予防と治療のための有害事象の数が最も少ない選択的 NSAID の指定とともに、プロトンポンプ阻害剤 (PPI) の使用が示されています。 パントプラゾール (元の医薬品である Controlock) は、臨床効果があるだけでなく、薬物相互作用が最小限に抑えられています。 この事実から、パントプラゾールは最も安全な PPI であると考えることができ、肝臓での代謝の類似した方法でいくつかの薬を処方する必要がある場合に利点が得られます。これらの薬の過剰摂取または効果の低下。
キーワード:非ステロイド性抗炎症薬 (NSAIDs)、NSAIDs-gastropathies、プロトンポンプ阻害薬、パントプラゾール、Controlock
引用のため: Balukova E.V. NSAID 誘発胃障害: メカニズムの理解から予防および治療戦略の開発まで // RMJ. 2017. No. 10. P. 697–702.
この記事では、NSAID による胃障害の問題を扱っています。
現在、非ステロイド系抗炎症薬(NSAID)は、臨床現場や日常生活で幅広い疾患に積極的に使用されており、さまざまな専門医の武器庫に含まれています。 世界中で毎日 3,000 万人以上が NSAIDs を鎮痛剤、抗炎症剤、抗血小板剤として使用しています。 20 世紀の終わりから今世紀にかけて、NSAIDs の消費量は 10 年ごとに 2 ~ 3 倍になる傾向があります。 年間に NSAIDs を服用している人の数は 3 億人を超えていますが、医師の処方に従って NSAIDs を服用しているのは 3 分の 1 にすぎません。 このような制御されていない摂取の結果は、胃腸の有害事象の発生率が高く、その範囲は非常に広く、軽度の消化不良からびらん(多くの場合複数)および消化性潰瘍の発生までさまざまです. したがって、NSAIDs を 6 週間以上使用する場合。 胃および十二指腸症は、患者の 70% で形成されます。 NSAID を長期間服用している患者の 30 ~ 40% で、NSAID 関連の消化不良の症状が発生します。 NSAID の服用に関連する消化不良の症状を示す患者の 1/2 では、内視鏡検査でびらんと出血が明らかになり、4 番目から 5 番目に 1 つずつ潰瘍が見られます。 NSAID を長期間服用している関節リウマチ患者では、消化器系の問題による入院または死亡のリスクは年間 1.3 ~ 1.6% と推定されており、胃腸 (GI) 合併症が一般的な原因の 1 つと見なすことができます。この場合は死亡の病気。 G. Singh の計算によると、NSAID の服用に関連する胃腸管からの危険な合併症により、米国では毎年 107,000 人の入院と 16,500 人の死亡が予測されています。
さらに、NSAIDs の服用は、胃食道逆流症 (GERD) の発症の独立した危険因子とも考えられています。 少なくとも週に 1 回 NSAIDs を服用している人は、NSAIDs を服用していない人、またはこれらの薬を週に 1 回未満服用している人よりも、GERD の症状が出る可能性が高くなります。 E.A. カラテフら。 NSAIDで治療されたリウマチ性疾患患者における食道病変症候群の発生率を研究し、この病状の発症の危険因子を特定する作業を実施しました。 食道胃十二指腸鏡検査の結果のレトロスペクティブ分析は、少なくとも 1 か月のリウマチ性疾患の 5608 人の患者で実施されました。 NSAIDの服用。 その結果、食道の病状(胸やけ、げっぷ、胸骨後部の痛み、嚥下障害)の存在に関連する臨床症状が35.0%の患者で観察されたのに対し、食道への器質的損傷 - びらん性食道炎は2.2でのみ発生したことがわかりました。 % の患者. . さらに、胃潰瘍および/または十二指腸潰瘍 (DU) が症例の 12.6% で検出され、このカテゴリーの患者では NSAID 食道症よりも NSAID 胃症を発症するリスクが高いことが確認されました。
NSAID胃症の臨床的変異
NSAID誘発性胃障害は、いくつかの臨床的形態で発生する可能性があります:胃腸管からの自覚症状(胃消化不良)、胃炎、急性潰瘍を含む胃粘膜および十二指腸のびらん性および潰瘍性病変、びらんおよび胃潰瘍からの出血およびDPC、頻度は低い - 潰瘍の穿孔。定期的にNSAIDsを服用している患者の20~40%に消化不良が起こり、患者の約10%は胃腸管からの不快な症状の出現によりNSAIDsの服用をやめます。 NSAID 胃炎とは異なり、消化不良の病因は NSAID の接触作用に関連しています。 これらの薬物は、上皮細胞の膜に局所的な悪影響を及ぼし、水素イオンの粘膜への逆拡散を引き起こし、続いて粘膜下層のpHを低下させ、痛みの受容体を刺激します。 消化不良の病因において特定の重要性があるのは、胃腸管の運動性を加速または減速する NSAID の能力です。 消化不良は、低用量のアセチルサリチル酸 (ASA) を含むすべての NSAID を引き起こす可能性がありますが、選択的 NSAID では非選択的 NSAID よりも発生頻度が低くなります。 この合併症は、潰瘍の既往歴のある個人や高用量の NSAID を服用している個人でより一般的です。
ほぼ 100% のケースで、NSAID を服用すると、1 週間以内に急性胃炎の内視鏡的徴候が現れます。 治療開始後(Drozdov V.N.、2005)。 . 胃および十二指腸のNSAID誘発びらん性および潰瘍性病変の主な症状には、心窩部痛、心窩部不快感、胸やけ、食欲不振、吐き気、腹部不快感、下痢などがあります。 一方、NSAID 胃炎では自覚症状がないことが非常に多く、例の 70% にいわゆる「無症状潰瘍」が存在し、穿孔や重度の胃十二指腸出血として現れることがあります。 胃腸管のNSAID誘発性病変を有する患者における症状の欠如は、プロスタグランジンの生合成の阻害-痛みと炎症のメディエーター、および純粋に主観的な感覚の両方によるものであり、症状の真の欠如によってではなく、事実によって明らかにされる.基礎疾患に関連する愁訴は、胃腸の症状よりもはるかに患者を悩ませます。 したがって、内視鏡検査は、NSAID 胃障害を診断するためのタイムリーで正確な唯一の方法です。 消化性潰瘍と NSAID 胃炎の鑑別診断基準を表 1 に示します。
さらに、古典的な消化性潰瘍とは異なり、NSAID-胃障害の特徴には、コースの再発性が含まれます。 主に最初の1〜3か月で、臨床(または内視鏡写真のみ)のデビュー。 NSAIDの服用開始から; 危険因子の組み合わせによってのみ予測できる胃腸病変の突然の発症。
これらの副作用の発生メカニズムはよく知られており、胃腸粘膜に対する NSAIDs の潰瘍形成効果によるものです。 同時に、びらん性潰瘍病変の局在化に関係なく、薬物の影響について2つの選択肢が考えられます。 1 つ目は、NSAIDs の吸収中の粘膜への直接的な損傷です (これは、前述のように、ASA とその誘導体に当てはまります)。 2 つ目は、プロスタグランジン、プロスタサイクリン、およびトロンボキサンの前駆体であるアラキドン酸代謝カスケードの重要な酵素であるシクロオキシゲナーゼ (COX) の阻害に関連する損傷です。 さらに、十二指腸胃逆流中の十二指腸および胃への肝排泄の結果として、NSAIDの活性代謝物が胆汁とともに再侵入する可能性があります。
抗炎症、鎮痛、および解熱活性の最も重要なメカニズムの 1 つと考えられているのは、COX-2 誘導性アイソフォーム (通常はほとんどの組織に存在しない) の阻害です。 これは、その発現と活性が炎症性刺激(マイトジェン、サイトカイン、成長因子)の影響下で局所的に現れ、炎症部位と全身の両方で炎症誘発性物質のレベルが上昇するという事実によるものです。接触感染。 COX-1の構成的アイソフォームの阻害は、プロスタサイクリンI2の欠乏を引き起こし、胃壁の血流を悪化させ、プロスタグランジンE2の合成の減少は、重炭酸塩と粘液の分泌の減少、酸産生の増加につながります、防御因子と攻撃因子の不均衡を増加させ、潰瘍形成を促進します。 特にNSAIDの長期使用を背景にした副作用の発生パターンは、胃腸管のすべての部分で注目されていますが、ほとんどの場合、胃十二指腸帯の領域で、とりわけ前庭部で表現されています。プロスタグランジン受容体の密度が高いところ。
胃腸粘膜への損傷の発生の危険因子
NSAIDによる胃障害の発症を予測することは可能ですか? NSAIDs の副作用は、これらの薬を服用しているすべての患者で観察されるわけではないことが知られています。 この現象の説明は、胃腸粘膜への損傷の発生の危険因子の存在に関連しており、その主なものは次のとおりです。- 65歳以上;
- 消化性潰瘍(消化性潰瘍)および歴史におけるその合併症;
- 高用量のNSAID;
- 複数のNSAIDまたはASAまたは他の抗血小板薬によるNSAIDの同時受信;
- グルココルチコステロイドホルモンによる併用療法;
– 治療期間; NSAIDの長期使用を必要とする疾患;
- ヘリコバクター・ピロリの存在;
- 女性 。
同時に、危険因子を層別化するとき、患者は3つのグループに分けることができます:
1) 高リスク - 消化性潰瘍の合併症、特に最近の合併症の病歴があり、3 つ以上の危険因子がある;
2) 中/中程度のリスク - 1-2 の危険因子;
3) 低リスク - 危険因子がないこと。
米国消化器病学会 (ACG (American College of Gastroenterology)) には、さらに次の危険因子が含まれています。 空腹時に薬を服用する(食事前); アルコール消費、喫煙、付随する心血管疾患。 次に、米国リウマチ学会は、NSAID を受けている RA 患者の出血リスクを計算するための特別な式を作成しました (表 2)。

NSAID 胃炎の発症において長い間、感染の役割の可能性はあいまいに解釈されてきました。 ヘリコバクター・ピロリ. 無作為化試験のメタ分析、およびマーストリヒト協定 IV によると、感染 ピロリ菌 NSAIDs の使用は、胃十二指腸潰瘍および潰瘍性出血の発症の独立した危険因子として認識されています。 同時に、NSAIDとピロリ菌の複合効果で胃十二指腸潰瘍を発症するリスクは61.1倍、潰瘍性出血を発症するリスクは、単独の効果と比較して6.13倍(それぞれ4.85倍と1.79倍)増加します。 )。 現在、ヘリコバクター ピロリ感染と NSAID の使用に関して、次の国際的な声明と推奨事項が採用されています。
1. 感染症 ピロリ菌低用量でNSAIDまたはASAを服用している患者では、単純または複雑な胃潰瘍および十二指腸潰瘍のリスクが高くなります。
2. 根絶により、NSAIDs または ASA を低用量で服用している患者において、複雑または単純な胃潰瘍および十二指腸潰瘍を発症するリスクが低下します。
3.根絶 ピロリ菌 NSAIDsを開始する前に有益な効果があります。 消化性潰瘍の既往歴のある患者には根絶が絶対に必要です。
4.根絶 ピロリ菌すでにNSAIDを長期間服用している患者の胃潰瘍および十二指腸潰瘍の発生率は減少しません。 この場合、除菌に加えて、プロトンポンプ阻害薬(PPI)の長期使用が適応となります。
5. 消化性潰瘍の病歴があり、ASA を服用している患者は検査を受ける必要があります。 ピロリ菌。根絶後の長期追跡調査の結果によると、そのような患者の潰瘍性出血の頻度は、胃保護治療がなくても低いです。
次に、2009 年に、NSAID 胃炎の予防のためのカナダ国家ガイドラインが発行されました。これには、この分野での最新の成果と国際的な合意文書の規定が含まれています。 コンセンサスによって提案された、胃障害の予防のための多くの規定とアルゴリズムを以下に示します。
従来の NSAID と ASA は、消化管からの出血やその他の合併症の発生率を高めます。 選択的COX-2阻害剤を使用すると、消化管合併症の頻度が増加しますが、従来の阻害剤よりも頻度が低くなります。 従来の NSAID または選択的 COX-2 阻害剤を投与されている患者に ASA を処方すると、消化管出血 (GI) のリスクが高まります。 クロピドグレルを ASA に追加すると、消化管出血のリスクが高まります。
NSAIDおよび/またはASAを使用する場合、患者が感染している場合、消化管出血のリスクが高まります ピロリ菌;
NSAID と ASA は、上部消化管の病理に特徴的な臨床症状の頻度を高めます。
潰瘍性出血の既往のある患者に選択的 COX-2 阻害剤を処方したり、従来の NSAID に PPI を追加したりしても、再出血の可能性は排除されません。 ただし、選択的 COX-2 阻害剤を PPI と併用した場合の出血のリスクは、COX-2 を単独で使用した場合よりも大幅に低くなります。
PPI は NSAID 胃炎の臨床症状を軽減します。
根絶 ピロリ菌 すでに ASA を服用している患者の上部消化管合併症のリスクを軽減します。 ただし、消化管リスクがある場合は根絶のみ ピロリ菌 NSAID胃障害の予防には不十分です。PPIも使用する必要があります。
NSAID胃炎の治療と予防
NSAIDsの服用により副作用が生じた場合は、まず使用適応を見直し、どうしても中止できない場合は減量するか、副作用の少ないお薬(選択的NSAIDs)を処方する必要があります。 しかし、選択的COX-2阻害剤は、非選択的阻害剤と同程度に、2つ以上の危険因子の存在下で手ごわい副作用を引き起こすことを覚えておく必要があります. そのため、英国の研究者によると、NSAID を服用した 9407 人の胃潰瘍患者では、使用した NSAID の選択性に関係なく、かなり高い出血リスクがありました。 さらに、心血管系に対する選択的COX-2阻害剤のいくつかの望ましくない副作用の報告により、この方向の対照臨床試験が終了し、臨床診療で広く使用されています。 COX-2 の存在が「構成的」アイソフォームとしていくつかの組織 (脳と脊髄、腎臓、骨組織) で示された研究もあります。 J.L. からのデータ ウォレス等。 COX-2 酵素は胃を保護するために必要である可能性があり、COX-1 は特に初期段階で炎症の発生に関与している可能性があることを示唆しています。米国リウマチ学会の勧告(2002)によると、NSAID による胃障害を予防するには、NSAID の服用中に胃十二指腸粘膜が損傷するリスクを評価する必要があります(表 3)。

NSAID-胃障害の臨床的特徴、すなわち、NSAIDの鎮痛効果による、消化不良の性質、発現の欠如、またはシグナル疼痛症候群の完全な欠如を伴う、最小数の苦情を伴う臨床像; 基礎疾患の治療に関連する薬物負荷の存在(NSAIDまたは他のグループの薬物と組み合わせたNSAID)により、医師は消化不良またはびらん性および潰瘍性病変の場合に予防薬と治療薬の両方をより慎重に選択する必要があります。消化管。 近年の研究を考慮に入れると、IPP はこれらすべての要件を満たしています。
組み合わせた(リウマチ、心臓、神経)病状を持つ患者でPPIを選択する場合、抗分泌薬の薬物相互作用の特徴が重要な役割を果たします。 肝臓の CYP2C19 アイソザイムへの影響は、かなりの数の薬物の代謝に関与しているため、重要です。 オメプラゾールと一部ランソプラゾールは、アンチピリン、カルバマゼピン、シクロスポリン、ジアゼパム、ジゴキシン、ニフェジピン、フェニトイン、テオフィリン、R-ワルファリン、クロピドグレルの代謝を遅らせることが示されています。 PPI の中で、パントプラゾールはシトクロム P450 システムに対して最も低い親和性を持っています。これは、このシステムでの最初の代謝の後、サイトゾル スルホトランスフェラーゼの影響下でさらなる生体内変化が起こるためです。 これは、他の PPI よりもパントプラゾールとの薬物間相互作用の可能性が低いことを説明しています。 この事実により、パントプラゾールを最も安全な PPI と見なすことができ、過剰摂取の症状や減少のリスクがないことを確認しながら、肝臓で同様の代謝経路を持ついくつかの薬を処方する必要がある場合に有利になります。これらの薬の効果で。
さらに、PPI の pH 選択性は重要であり、その低い値は、長期の PPI 治療中の潜在的な副作用の発症機序として議論されています。壁細胞に加えて、他の臓器や組織の細胞で確認されています:腸および胆嚢の上皮、腎尿細管、角膜上皮、筋肉、免疫系の細胞(好中球、マクロファージおよびリンパ球)、破骨細胞など。 このことから、PPI が壁細胞の分泌細管の外側で活性化されるとすれば、これらすべての構造にそれらが影響を与えるという理論的な可能性があるということになります。 既知の PPI のうち、パントプラゾールは最も pH 選択性が高く、ラベプラゾールは最も pH 選択性の低い PPI です。 主な胃腺の壁細胞の外側にあるプロトンポンプの遮断は、薬物の長期使用で深刻な合併症を引き起こす可能性があるため、この状況の臨床的意義を過大評価することはほとんどできません. 例えば、好中球活性の阻害は肺炎の発生率の増加につながる可能性があり、破骨細胞の成熟障害は股関節骨折のリスクを高める可能性があります。時間。
ロシアで発表された元のパントプラゾールの唯一の代表はControlocです。 この薬は、Good Clinical Practice (GCP) および Good Manufacturing Practice (GMP) のすべての要件を満たし、高い臨床効果を持ち、使用に関するすべての安全要件を満たしています。 治療で上部消化管粘膜に刺激や損傷を与える薬剤を使用している多発性疾患患者のうち、薬物療法を必要とする高齢層の患者が大部分を占めているため、適切な薬剤を選択して予防と治療を行うことが重要です。薬物療法の潰瘍形成効果の結果、または酸依存性病理、特にGERDおよび消化性潰瘍疾患の治療。 Controloc は同様の要件を満たしていますが、その重要な特性は、腎不全や肝不全の患者を含む高齢患者の用量調整が不要であることです。 F. Mearin等。 ランソプラゾール、パントプラゾール、ミソプロストール (200 mg を 1 日 4 回) が、腹痛、胸やけ、膨満感、胃の膨満感/急速な膨満感などの NSAID 誘発性消化不良の症状を排除する効果について、プラセボ対照比較が行われました。腹部の満腹感/膨満感、および別の痛みと胸やけ。 12週目の終わりまでに パントプラゾールによる治療は、使用された用量に関係なく、66%の症例で消化不良の症状、77%で腹痛、87%で胸やけの症状を消失させました。
NSAIDs の治療中に発生する胃と十二指腸の病変を確実に予防する問題は、依然として議論の対象となっています。 PPI は、NSAID 関連の胃潰瘍および十二指腸潰瘍の予防に最も効果的です。 患者は、臨床状況が必要とする限り、指示に従って PPI を受けることができます。 一方、このクラスの個々の代表者(パントプラゾール(Controloc))の利点を考慮に入れる必要があり、理論的および潜在的なリスクを平準化することができます。
文学
1.リウマチ性疾患の合理的な薬物療法:開業医のためのガイド/編。 編。 V.A. Nasonova、E.L. ナソノフ。 M.: リテラ、2007 年。434 ページ。 .
2. Nasonov E.L.、Karateev A.E. 非ステロイド性抗炎症薬の使用。 臨床ガイドライン // RMJ. 2006. No. 25. S. 1769.
3. ラナス A. 胃腸の安全性データのレビュー – 胃腸科医の視点 // リウマチ学. 2010年Vol。 49(2)。 P. 3–10。
4. Maev I.V.、Lebedeva E.G. 高齢者における非ステロイド性抗炎症薬の使用によって誘発される胃障害の治療 // ポリクリニック医師のハンドブック。 2011. No. 3. S. 26–31.
5. ブラウン T.J.、フーパー L.、エリオット R.A. ら。 非ステロイド性抗炎症薬による胃腸毒性の予防のための 5 つの戦略の費用対効果の比較: 経済モデリングを使用した系統的レビュー // Health Technol Assess. 2006年Vol。 10(38)。 R. 1183.
6. Singh G.、Ramey D.R.、Morfeld D.ら。 関節リウマチにおける非ステロイド性抗炎症薬治療の消化管合併症 // Arch. インターン。 医学。 1996 巻。 156. P. 1530-1536。
7.非ステロイド性抗炎症薬の使用によって誘発された消化器の病変/合計未満。 編。 AV。 Shabrova、Yu.P。 ウスペンスキー。 サンクトペテルブルク: InformMed, 2013. 284 p. .
8. Karateev A.E.、Uspensky Yu.P.、Pakhomova I.G.、Nasonov E.L. NSAID の服用と食道の病理学: 胃食道逆流症 (GERD) の主な症状との関係、びらん性食道炎の発生率と危険因子 // 実験。 そしてくさび。 消化器科。 2008. No. 3. S. 11–16.
9. パコモバ I.G. NSAID による胃障害 // BC のリスクを最小限に抑える新しい機会。 2014. No. 10. S. 772.
10. ドロズドフ V.N. 非ステロイド系抗炎症薬による胃障害:病因、予防、治療 // Consilium Medicum. 消化器科。 2005. V. 7, No. 1. S. 35–38.
11. Trukhan I. NSAID 胃炎の予防と薬物安全性の観点からの非ステロイド性抗炎症薬の選択 // Consilium Medicum。 2014. No. 8. P. 14–19.
12. ラピナ T.L. 非ステロイド性抗炎症薬によって引き起こされる胃障害: 問題を解決する方法 // BC. 2009. No. 2. S. 54.
13. Pakhomova I.G.、Belousova L.N. 非ステロイド性抗炎症薬の使用に関連する上部消化管の病変//効果的な薬物療法。 神経学。 2014. No. 5. P. 49.
14. ホーキー C.J.、ラナス A.I. 2000 年の非ステロイド性抗炎症薬に関する疑いと確実性: 学際的な専門家の声明 // Am J Med. 2001年Vol。 110. P. 79–100.
15. Uspensky Yu.P.、Baryshnikova N.V.、Orlov O.Yu.、Aleksandrova Yu.A. 胃腸管のNSAID関連病理学:薬の選択、患者管理の戦術 ポリクリニック医師のハンドブック。 2014. No. 8. S. 42–47.
16. Karateev A.E.、Yakhno N.N.、Lazebnik L.B. およびその他の非ステロイド性抗炎症薬の使用。 臨床ガイドライン/編。 A.E. カラテフ。 M.: IMA-press, 2009. 167 p. .
17. チャン F.K. David Y. Graham の講義: COX-2 制限環境での非ステロイド系抗炎症薬の使用 // Am J Gastroenterol. 2008年Vol。 103(1)。 P. 221–227。
18. Lanza F.L.、Chan F.K.、Quigley E.M. NSAID 関連の潰瘍合併症の予防のためのガイドライン // Am J Gastroenterol. 2009年Vol。 104. P. 728–738。
19. フライドポテト ら。 非ステロイド系抗炎症薬関連胃障害:発生率および危険因子モデル // Amer. J.Med. 1991 巻。 91. P. 213–222。
20. Venerino M.、Malfertheiner P. 胃潰瘍および十二指腸潰瘍におけるヘリコバクター ピロリ感染と非ステロイド性抗炎症薬の相互作用 // ヘリコバクター。 2010年Vol。 15. P. 239–250。
21. Malfertheiner P.、Megraud F.、O'Morain C.ら。 ヘリコバクター ピロリ感染の管理: マーストリヒト IV/フローレンス コンセンサス レポート // Gut. 2012年。 61. R. 646-664。
22. Rostom A.、Moayyedi P.、Hunt R. 長期の非ステロイド系抗炎症薬療法と胃保護の必要性に関するカナダのコンセンサス ガイドライン: メリットとリスク // Aliment。 薬理学。 そこ。 2009年Vol。 29. P. 481–496。
23. Pimanov S.I.、Semenova E.V.、Makarenko E.V. 抗血小板薬および非ステロイド性抗炎症薬によって引き起こされる胃十二指腸潰瘍: 新しい推奨事項による予防 // Consilium Medicum. 2009. No. 8. S. 13–20.
24. ホーキー C.J.、スケリー M.M. 選択的 COX-2 阻害剤の胃腸の安全性 // Curr. 薬。 デス。 2002 巻。 8. P. 1077–1089。
25. キーン W.F.、ブキャナン W.W. リウマチ性疾患における NSAID の使用 2005: グローバルな視点 // Inflammopharmacol. 2005年Vol。 13(4)。 P. 343–370。
26. FDA 公衆衛生勧告: FDA は、COX-2 選択的および非選択的非ステロイド系抗炎症薬 (NSAID) に関する重要な変更と追加の警告を発表します。
27. Martel-Pelletier J.、Lajeunesse D.、Reboul P.、Pelletier J.P. 5-LOX と COX の二重阻害剤、選択的および非選択的非ステロイド性抗炎症薬の治療的役割 // Ann. レウム。 ディス。 2003年Vol。 62(6)。 P. 501–509。
28. ウォレス J.L. ら。 シクロオキシゲナーゼ 1 は、ラットとマウスの炎症反応に寄与します: 胃腸毒性への影響 // Gastroenterol. 1998 巻。 115. P. 101–109。
29. Blume H.、Donath F.、Warnke A.、Schug B.S. プロトンポンプ阻害剤の薬物動態学的薬物相互作用プロファイル // 薬物安全性。 2006年Vol。 29(9)。 P. 769–784。
30. Gileva V.V.、Kvetnaya T.V.、Proshaev K.I. 多発性病理学の神経内分泌の側面 // 資料集 65 番目のスタッド。 conf。 そして第36回大会。 彼らが言うには うーん。 SGMA。 スモレンスク、2008 年、53 ~ 54 ページ。
31.コートG.A.、ハウデンC.W. プロトンポンプ阻害剤の潜在的な悪影響 // Curr Gastroenterol Rep. 2008年Vol。 10(3)。 P.208–214。
32. Moldin I.M.、Sachs G. 酸関連疾患。 生物学と治療 // Schnetztop-Verlag GmbH D-Konstanz. 1998. R. 126-145.
33. Bliesath H.、Huber R.、Hartmann M.ら。 単回静脈内投与後の新しい H+/K+-ATPase 阻害剤パントプラゾールの薬物動態の用量直線性 // Int J Clin Pharmacol Ther. 1994 巻。 32(1)。 P. 44–50。
34. Mearin F.、Ponce J. 強力な酸阻害: 証拠と臨床応用の要約 // 薬物。 2005年Vol。 65(1)。 R. 113–126。
NSAID-胃障害は、胃粘膜の病理学的変化を特徴とし、その原因は抗炎症性非ステロイド薬の長期使用です。 NSAID-胃障害は、疾患の症状がないか軽度の重症度を特徴とします。
非ステロイド性抗炎症薬は、炎症を治療し、痛みを和らげるために使用される最も一般的な薬と考えられています. 最近、このタイプの薬の使用は数倍に増えています。 この点で、この種の薬の長期使用による胃粘膜の損傷の患者数も増加しています。 NSAID 胃炎は、NSAID を長期間服用している患者の 3 分の 1 で診断されます。
非ステロイド性抗炎症薬は、通常、関節リウマチの患者、骨軟骨症などの病状、痛風、変形性関節症、その他の慢性疼痛症候群の患者に使用されます。
非ステロイド性抗炎症薬の長期使用による胃の粘膜の特定の病変から、臓器の古典的な粘膜病変を区別するために、医学用語「NSAID-胃障害」が導入されました。
患部は十二指腸ではなく上部消化管であることが多い 12. 検査では、びまん性びらん、紅斑、微小出血、クレーター状の潰瘍が明らかになります。
NSAID胃障害の原因
このタイプの胃障害は、非ステロイド系薬剤による 4 週間以上の長期にわたる継続的な治療の後に発生します。 さらに、病気を発症するリスクを高める追加の要因があります。 これらには以下が含まれます:
- 高齢者。 胃腸管の加齢に伴う変化により、NSAIDの服用中に病理を発症するリスクも高まります。
- 消化性潰瘍の病歴。 薬の服用は胃粘膜に悪影響を及ぼし、びらん性変化を繰り返します。 細菌ヘリコバクター ピロリの存在は、病気の経過を悪化させます。
- 使用済みの非ステロイド薬の投与量を超えるか、このタイプのいくつかの種類の薬を併用する。 薬を併用すると、副作用が増します。 最大は、投薬の最初の月に観察されます。 これは、体がNSAIDの影響に適応する期間によるものです。
- 付随する病状の存在 - 動脈性高血圧症、冠状動脈性心臓病など。
- 別の方向の薬と組み合わせたNSAIDの使用。 グルココルチコステロイドと一緒に NSAID を使用すると、病状のリスクが高まります。 抗凝固療法中に NSAID を使用すると、びらん性出血のリスクが高まります。
- 女性。 女性は非ステロイド薬を使用する可能性が高くなります。 それらの使用は、月経痛、ストレスと疲労を背景にした頭痛で発生します。
- 悪い習慣を持つ。 アルコールの消費と喫煙の乱用は、胃十二指腸粘膜に有害な影響を及ぼし、その刺激とそれに続く炎症を引き起こします。
これらの負の依存は、NSAID の使用とともに、びらん性および潰瘍性変化のリスクを高めます。
病気を発症するリスクは、NSAID を服用している患者の危険因子の数を考慮して推定されます。 リスクには 3 つのレベルがあります。
- 高度のリスクは、NSAID胃炎の形成の素因となる2つ以上の要因の存在および/または病歴における複雑な潰瘍の存在によって特徴付けられます。 この場合、患者はNSAIDの服用を避けるか、保護薬と組み合わせて最小用量で使用することをお勧めします.
- 適度。 この状態は、1〜2の危険因子の存在によって示され、病歴に合併症のない潰瘍が存在します。 NSAIDs は保護療法と組み合わされます。
- 低い。 これは、危険因子がないことを意味します。 この場合、患者は予防のために薬を処方する必要はありません。
NSAID 関連の胃障害は、薬を服用しているすべての患者に発生するわけではありません。 一部の人々は、健康に大きな害を及ぼすことなく、このグループの薬を長期間服用できます。
粘膜損傷の一因となる主なメカニズムは、シクロオキシゲナーゼ酵素の遮断であると考えられています。 この酵素は、COX-1 と COX-2 の 2 つの異性体で表されます。 これらの最初のものは、NSAID の副作用に関連しています。 
COX-2の遮断は、リウマチ学および神経学におけるこれらの薬物の使用の基礎と考えられている抗炎症および鎮痛効果を説明しています.
COX-1の分泌が減少すると、臓器の粘膜でのプロスタグランジンの産生が減少し、胃液の攻撃性が高まり、局所保護因子の機能が低下します。
NSAIDを長期間使用すると、脂質過酸化が活性化され、フリーラジカルが組織に蓄積し、一酸化窒素合成の抑制が始まります。これは、胃障害の発症においてさらに重要です。
病気の症状
NSAID 胃炎の臨床症状はさまざまです。 症例の半分では、この病気には症状がなく、その診断は合併症の段階でのみ行われます。
他の場合には、次の症状が発生します:上腹部の吐き気、痛みと重さ、食欲減退、鼓腸、排便頻度の変化 - 下痢または便秘。
痛みは夜に起こりやすいです。 内視鏡検査の結果と疾患の臨床像との間に食い違いが見られることがよくあります。
一部の患者では、消化器官の粘膜の複数の潰瘍が痛みのない状態で観察され、逆に、重度の症状では、粘膜に内視鏡的変化がない場合があります。
無症候性の NSAID 胃炎は、多くの場合、消化管出血の診療所で始まり、コーヒーかすの形で嘔吐し、黒い便が現れることがあります。 これは、低酸素症を伴う血行動態障害および生命維持に必要な臓器への血液供給の障害を伴います。 そのような患者はしばしば遅れて医療援助を求め、出血を背景にNSAIDを服用し続け、状況をさらに悪化させます.
診断の確立
病理の徴候および病理の内視鏡的および臨床像における不一致のための多くの選択肢があるため、NSAID胃炎の診断は重大な困難を引き起こす可能性があります。 専門家(消化器内科医)を診察し、既往歴を明らかにし、症状を特定した後、医師は病理学の発症とNSAIDの使用との関係を特定できます。 
診断の次の段階は、次の機器研究方法の任命です。
- 食道胃十二指腸鏡検査。 この方法は、病理学的過程の経過の位置と強度、潰瘍の数、および胃腸粘膜の一般的な状態を決定します。 また、研究の過程で、潰瘍およびびらんの生検が行われます。
- コントラストのある胃のレントゲン写真。 EGDSが不可能な場合に使用されます。
診断において二次的な役割を果たしている実験室研究方法の中で、次のものを区別することができます。
- 潜血の存在に関する糞便の分析;
- 細菌の存在を確認するための検査 (PCR、ELISA、生検研究など);
- pHメーター。 胃液の酸性度を決定し、攻撃的な危険因子を診断することが可能になります。
NSAID-胃障害の鑑別診断は、胃潰瘍で行われます。 胃の悪性病変を伴うZollinger-Ellison症候群でも鑑別診断が行われます。
膵臓、肝臓、胆嚢から病状を除外するために、腹膜の超音波検査が行われます。
MRIまたはCTは、追加の研究として診断を明確にするために処方されます。
病気の治療
何らかの理由でNSAIDのキャンセルが不可能な場合、患者はプロトンポンプ阻害剤(PPI)(ランソプラゾール、オメプラゾール、ラベプラゾール、パントプラゾール)を使用した個別の治療レジメンを処方されます。 治療は1~2ヶ月継続して行います。 
また、プロスタグランジンE1の類似体(「Misoprostol」、「Enprostil」)を使用した治療では、細胞保護効果があり、胃の粘液の合成が増加します。
さらに、胃保護剤(「De-nol」)とエンベロープ剤(「Phosphalugel」)が摂取されます。
ヘリコバクター・ピロリの存在下では、抗菌薬による除菌療法が処方されます。
合併症が発生した場合は、手術が行われます。 出血を止めるために、内視鏡止血操作と凝固剤の同時非経口投与が行われます。 広範囲の出血、潰瘍の穿孔、大きな潰瘍性欠損、欠損の切除と縫合、胃腸造瘻術、胃切除が行われます。
病理の合併症
NSAID 胃炎の最も一般的な合併症は、潰瘍からの出血です。 この状態は、適切な治療が行われないと、出血性ショックの出現につながり、将来的には死に至る可能性があります。
胃の内容物が腹腔に入ると、腹膜炎が始まる可能性があるため、潰瘍の穿孔は危険です。 血流への毒素の浸透により、体の中毒が発生する可能性があり、敗血症の発生を伴う腹膜炎の長期経過があり、その後外科手術が必要になります。
天気
NSAIDの正しい使用、危険因子のタイムリーな特定、および胃障害の予防により、病理の予後は非常に良好です。
病理の予防
この病気の予防は、危険因子の数の減少を含む、次の推奨事項で構成されています。
- 可能な限り最小の有効用量で、可能であれば短期間で薬を服用します。
- 同じグループの2つ以上のタイプのNSAIDの同時投与を回避するための投与レジメンの使用。
- 食後の薬の服用。
- NSAIDの医薬品タイプの改善:直腸坐剤、非経口投与用の溶液、パッチ(治療の最初の2週間で胃障害のリスクを減らします)。
- 抗分泌薬の予防投与。
NSAID胃炎は、消化不良や痛みの症状として現れるだけでなく、穿孔、潰瘍、出血など、潜在的に危険な隠れた現象として現れることもあります。 古典的な消化性潰瘍疾患とは異なり、NSAID-胃障害は十二指腸ではなく上部消化管に影響を与えることが多く、通常は高齢の患者に発症します。 胃鏡検査では、紅斑、びまん性びらん、微小出血、およびクレーター状の潰瘍が明らかになります。
NSAID-胃障害の原因
非ステロイド性抗炎症薬(NSAID)を服用している患者は、胃十二指腸合併症を発症する可能性があります。 患者の胃腸管からの苦情の存在は、胃粘膜のびらん性および潰瘍性の変化の発生について常に話すことを可能にするわけではありません。 長期 (6 週間以上) の NSAID 治療を受けている患者の約 30 ~ 40% は、内視鏡検査中に得られたデータと相関しない消化不良の症状を示します。上部消化管は文句を言わず、反対に、消化不良患者の50%で、粘膜の正常な状態が認められました。
NSAIDを処方する際に胃潰瘍や合併症を発症するリスクを高める要因:
- 65歳以上;
- 歴史における消化性潰瘍;
- 複数のNSAIDの大量または同時使用;
- グルココルチコステロイド(GCS)による併用療法;
- 長期治療;
- NSAIDの長期使用を必要とする疾患の存在;
- 女性;
- 悪い習慣:喫煙、飲酒。
- 可用性 ひ. ピロリ菌.
長年の研究の過程で、NSAID に対する女性の感受性の増加が確立されました。 NSAIDとグルココルチコステロイド(GCS)を併用すると、消化管のびらん性および潰瘍性病変を発症するリスクが10倍になります。 合併症のリスクの増加は、全身作用によって説明できます。 酵素ホスホリパーゼA2をブロックするGCSは、細胞膜のリン脂質からのアラキドン酸の放出を阻害し、プロスタグランジンの形成を減少させます。 NSAID の使用量と使用期間は、胃十二指腸潰瘍とその合併症の発症の決定的な危険因子の 1 つです。 長期間の治療では潰瘍の高いリスクが観察され、薬を服用してから最初の月に最大になります。 将来のリスクの減少は、明らかに適応メカニズムによって説明されます。 NSAID はいずれも粘膜損傷を引き起こす可能性がありますが、一部の著者によると、薬剤のグループによって合併症の相対的リスクは異なります。 服用時の合併症の最大のリスク ピロキシカムそして徐々に減少します インドメタシン, ナプロキセン , イブプロフェン. NSAIDs のさまざまなグループを組み合わせて使用すると、それらの副作用がまとめられます。 服用する薬の量も重要な役割を果たします。 したがって、通常の総投与量を超えると、合併症のリスクが4倍になります。
現在、NSAID による胃障害の予防と治療には、第 2 世代の H2 受容体遮断薬である 3 つのグループの薬が使用されています。 ラニチジンと ファモチジン第 3 世代、第 1 グループの H+K+AT フェーズ ブロッカー オメプラゾール、プロスタグランジンE1の第2グループ合成類似体 ミソプロストール.
HCl 酸の生成をブロックする薬を処方する根拠は、次の結果に焦点を当てたものです。
- 胃間pHが4以上、特に6に近づくことによるペプシン活性の低下またはその不活性化は、NSAID誘発胃障害の治療における主要な課題の1つです。
- H +の逆拡散と胃粘膜へのそれらの損傷効果の減少。
酸産生の抑制は、たとえNSAIDを長期間使用したとしても、潰瘍の瘢痕化とびらんの上皮化につながることが確立されており、これは何年にもわたって薬を服用しなければならないリウマチ性疾患の患者にとって特に重要です. NSAID誘発性の胃および十二指腸症の予防のための主な薬は以下のものです。 ミソプロストール- プロスタグランジン E1 の合成類似体。 さらに、この薬は、NSAIDsを服用していてリスクのある患者が重篤な合併症を発症するリスクを軽減します。 粘膜感染症におけるNSAID誘発性胃および十二指腸症の患者で検出された場合 ひ. ピロリ菌、抗菌薬の任命を補足することをお勧めします。
NSAID 胃炎のリスクを軽減する効果的な方法は、副作用が最も少ない薬を使用することです。 イブプロフェン, ジクロフェナク .
タブ。 NSAID 服用中の胃障害および心血管合併症の危険因子
|
リスク等級 |
NSAID 胃炎 |
心血管事故 |
|
適度 |
高齢、グルココルチコステロイドの使用、喫煙および飲酒、潰瘍リスクの既往歴、感染症 ひ. ピロリ菌 |
高血圧の代償治療、冠状動脈性心疾患の臨床的または機器的前提条件がない場合の梗塞の危険因子の存在 |
|
潰瘍歴、アスピリンやその他の血液凝固に影響を与える薬の服用 |
非代償性高血圧、心不全の徴候、合併症のない冠動脈疾患、不安定狭心症 |
|
|
最大 |
消化管出血、潰瘍穿孔、しばしば再発性潰瘍、特に NSAID 誘発性潰瘍 |
IHD + 心筋梗塞の既往歴、手術後の状態(冠動脈バイパス術)、虚血性脳卒中 |
NSAIDsを受けている患者を管理する戦術:
- 治療前に患者の消化器官と心血管合併症の危険因子を評価します。
- 慢性疾患の存在を考慮に入れます。
- NSAID に対する皮膚反応の履歴に注意してください。
- 患者が重度の慢性疾患を患っている場合、関連する専門分野の医師と協力してNSAIDの予約が行われます。
- 治療の前に、内視鏡検査、全血球計算、アラニンアミントランスフェラーゼ(ALT)、ASTH、ビリルビン、血中クレアチニンのレベルを決定する必要があります。
- 治療は最も毒性の低い薬から始めるべきです。
- 必要最小限の用量を使用します。
- ポリファーマシー(複数の薬物の同時使用)を避けることが望ましい。
- NSAID を投与されている患者を監視する必要があります。
---------
アレクセイ・オレゴビッチ・ブエベロフの報告によると、第一モスクワ州立医科大学の医療および社会的専門知識およびポリクリニック療法の教授です。 彼ら。 Sechenov、d.m.s。 XXIVロシア国民会議「人と医学」の枠組み内のシンポジウムで