保存的治療、外科的治療、および併用治療のレジメンを選択するときは、形成の種類、そのサイズ、および成長の特徴が考慮されます。 薬物療法の主な目的は、臨床症状を軽減または除去するだけでなく、病気の原因や発病における個々の関連性に影響を与えることです。 この目的のために、患者には以下が処方されます。
ホルモン剤。ホルモン療法は、ホルモンレベルの変化(エストロゲン、FSHおよびLHレベルの上昇、プロゲスチンの過剰または欠乏、低エストロゲン血症、高プロラクチン血症)を伴う腫瘍の形態にのみ適応されます。 腫瘍の種類に関するデータに基づいて、エストロゲン、プロゲステロン含有薬、選択的エストロゲン受容体調節薬、抗プロラクチン薬、および下垂体性腺刺激ホルモン阻害薬が使用されます。 ホルモンレベルの補正は、上皮由来の空間占有形成の治療により効果的です。
非ホルモン剤。排卵後の激しい痛みを軽減するには、非ステロイド性抗炎症薬、鎮静剤(通常はハーブ由来)、および少量の利尿薬(痛みに乳腺の腫れが組み合わさっている場合)が推奨されます。 ビタミン療法(特に抗酸化作用のあるビタミンAとビタミンE)や、G2期の腫瘍細胞の増殖を阻止し、多くの遺伝子を阻害するセレン製剤が効果的です。 肝臓におけるステロイドの代謝を改善するために、肝保護剤が使用されます。
場合によっては、基本的な非ホルモン療法およびホルモン療法の処方が手術の前に行われることもあります。 最新の診断方法の使用により、外科的治療の適応は大幅に制限されており、ほとんどの患者は動的観察が適応となります。 原則として、線維腺腫、葉状腫瘍、乳管乳頭腫、限局性増殖性乳腺症における結節形成、増殖を伴う大きな(20 mm以上)嚢胞が除去の対象となります。 組織学的構造、大きさ、位置を考慮して、腫瘍の核出、皮膚病変の除去、または乳房の部分切除が行われ、続いて組織の組織学的検査が行われます。 乳管乳頭腫の一部の形態では、乳管の選択的分離が可能であり、乳輪下領域の周囲構造が保存されており、これは若い患者にとって特に重要です。 嚢胞は硬化を起こす可能性があります。
食事とライフスタイルの修正は、乳房の良性形成の複雑な治療において重要な役割を果たします。 乳腺に腫瘍が見つかった場合は、喫煙と飲酒をやめ、夜間に十分な睡眠(少なくとも8時間)をとり、運動し、ストレスの多い状況を避けることが推奨されます。 食事では、ステロイドホルモンの代謝に影響を与える脂肪分の多い肉や燻製肉、また水分を保持し結合結合の合成を促進するピクルス、チョコレート、ココア、濃茶、コーヒー、コーラの量を制限する必要があります。組織繊維。 食事には、果物(特に柑橘類)、野菜(特にカロチンが豊富)、シリアル、および繊維が豊富な食品を補給する必要があります。 1日あたり最大1.5〜2リットルのきれいな水を飲む必要があります。
分類は通常、がんの病期を決定する TNM システムに従って考慮されます。 ただし、より正確な診断を行うために他の分類も使用されます。 ここでは主なものについて説明します。
ICD 10 によるがんの分類
- C50 乳房の悪性新生物。
- C50.0 乳首と乳輪。
- C50.1 乳腺の中央部分が影響を受けます。
- 内側上部の C50.2 病変。
- 内側下部の C50.3 病変。
- 上部外側象限の C50.4 病変。
- 外側下象限の C50.5 病変。
- C50.6 腋窩領域。
- 50.8 で複数のポジションを破った場合。
- C50.9 の癌発生の局在は決定されていません。
- D05.0 上皮内小葉癌。
- D05.1 上皮内乳管内癌。
組織学的分類
A. 非浸潤がん
- 管内;
- 小葉状。
B. 浸潤がん
- 乳管;
- 小葉状。
- ぬるぬる;
- 髄質;
- 管状;
- アポクリン;
- 他の形態(乳頭状、若年性など)。
C.スペシャル
- パジェットがん。
- 炎症性の癌。
現在診断されているがんの最も一般的な形態は、扁平上皮がんとパジェットがんです。
腫瘍増殖速度による分類
腫瘍の増殖速度はその悪性度を示し、その速度は放射線診断を使用して決定されます。 例えば:
- 急速に成長する腫瘍 - これは、2 か月以内に腫瘍量が 2 倍に増加することを特徴とします。
- 中程度に成長する腫瘍 - これは、1 年以内に腫瘍量が 2 倍に増加することを特徴とします。
- ゆっくりと成長する腫瘍 - これは、1 年以上にわたって腫瘍量が 2 倍に増加することを特徴とします。
TNM分類
T - 原発腫瘍
- TX - プライマリは評価には使用できません。
- TO - 原発腫瘍の兆候はない。
- これは癌です。
- Tis (DCIS) - 乳管癌;
- Tis (LCIS) - 小葉癌;
- Tis (パジェット) - 乳頭のパジェット病。浸潤癌とは関連しません。
- T1 - サイズが最大 2 cm の腫瘍。
- T2 - 腫瘍の大きさは 2 ~ 5 cm。
- T3 - 5 cm を超える腫瘍。
- T4 - 皮膚または胸壁に広がった任意のサイズの腫瘍。
N - 所属リンパ節
- NX - 評価できない所属リンパ節。
- N0 - 所属リンパ節に転移は存在しません。
- N1 - 腋窩リンパ節における転移の存在、レベル I.II、互いに融合していない。
- N2 a - レベル I.II リンパ節の腋窩領域に転移が存在し、互いに融合している。 (c - 臨床徴候および腋窩リンパ節に転移がない場合の内部乳房リンパ節)。
- N3 a - レベル III の鎖骨下リンパ節における転移の存在 (c - 内乳房および腋窩リンパ節における転移の存在、鎖骨上リンパ節における転移)。
M - 遠隔転移。
- Mo - 遠隔転移の存在は確認されていません。
- M1 - 遠隔転移が存在します。
乳がんの種類
ホルモン依存性
ホルモン依存性 - 乳がんなどの病気は、女性の体のホルモン背景に直接依存します。 現在、ホルモンバランスの乱れを引き起こす要因は数多くあります。
乳腺過形成のほぼすべての形態は、内分泌系の混乱の結果です。 これらはすべて、体内のエストロゲン、プロラクチンの増加、プロゲステロンの減少によって引き起こされます。
同様に、これらのホルモンの機能不全により、乳がんが発生し始めます。
科学者たちは、ホルモン避妊薬の長期にわたる継続的な使用が乳がんの原因の一つであることを証明しました。 基本的に、この病気の治療複合体にはホルモン剤が含まれます。
陰性乳がん
陰性乳がんは、重篤な疾患の 1 つです。 治療が難しい。 実験室の方法によってのみ決定されます。 他のタンパク質と異なる点は、エストロゲン、プロゲステロン、および特定の腫瘍タンパク質という主要な 3 つのタンパク質に対する受容体を持たないことです。
管腔内乳がん
管腔内乳がんはA型とB型の2種類に分けられます。
Luminal A. 症例の 33 ~ 41% が閉経期の女性で診断されます。 この種類のがん細胞は次のとおりです。
- 受容体はエストロゲンとプロゲステロンによく反応します。
- 受容体は実際には細胞増殖マーカー Ki67 に反応しません。
- 受容体は細胞特異的タンパク質 HER2-neu に応答しません。
この種類のがんは治療可能性が高いです。 治療にはホルモン療法が用いられます。
Luminal B. 症例の 15 ~ 20% の割合で、出産適齢期の女性に発生します。 近くのリンパ節への転移が特徴です。 この病気は治療が非常に困難です。 基本的に、がん細胞の増殖を止めることはできません。
がんの段階
がんには4つの段階があります。
最初の(初期)段階
特徴は次のとおりです。
- 腫瘍の大きさが2cm以内。
- 転移がないこと。
第2段
特徴は次のとおりです。
- 腫瘍の大きさは2〜5cm。
- リンパ節内の転移の存在;
- 離れた臓器への単一転移の可能性があります。
第三段階
特徴は次のとおりです。
- 腫瘍サイズが5cmを超える。
- 腋窩領域のリンパ節における転移の存在(リンパ節は転移とは別に決定される)。
- 遠隔転移が起こる可能性があります。
第4段階
特徴は次のとおりです。
- 腫瘍のサイズは大きく、主に乳腺の外側に位置します。 ノードを伴う場合があります。
- 両側のリンパ節に転移。
- 離れた臓器への多発転移。
ビデオ: 乳がんの分類
medik-24.ru
乳がんの分類
悪性腫瘍の TNM 分類は、WHO によってすべての悪性新生物に対して採用されており、乳がんの段階を決定します。 乳がん腫瘍学については、第一線の専門家の推奨に基づいて、詳細を導入して適応されています。
乳がんの TNM 分類は、腫瘍のサイズ、脇の下、首、乳房のリンパ節への広がりに基づいて腫瘍の解剖学的グレードを測定し、転移の存在を記録します。 この乳がんの国際分類は、国際乳がん協会および欧州臨床腫瘍学会 (EUSOMA) によって採用されています。
TNM 分類によると、乳がんには次の段階があります。
- T0 – 乳がんの兆候は検出されませんでした(証明されていません)。
- Tis (上皮内腫瘍) という名称は癌腫を指し、次のことを表します: 異常な細胞がその場で見つかり (浸潤なし)、局在が乳腺の管 (DCIS) または小葉 (LCIS) に限定されています。 乳房の乳首と乳輪の組織に影響を及ぼすティス・パジェット、つまりパジェット病もあります。
- T1 – 最も広い点での腫瘍の直径が 20 mm 以下である:
- T1a – 腫瘍直径 > 1 mm、ただし
- T1b – 腫瘍直径が 5 mm を超え 10 mm 未満。
- T1c – 腫瘍直径 > 10 mm ただし ≤ 20 mm。
- T2 – 腫瘍直径 > 20 mm、ただし
- T3 – 腫瘍の直径が 50 mm を超えています。
- T4 – あらゆるサイズの腫瘍が転移しています:胸部(T4a)、皮膚(T4b)、胸部と皮膚(T4c)、炎症性乳がん(T4d)。

リンパ節の指標:
- NX – リンパ節を評価できません。
- N0 – リンパ節にがんは見つかりませんでした。
- N0 (+) – 「孤立した」腫瘍細胞の小さな領域 (0.2 mm 未満) が腋窩リンパ節に見られます。
- N1mic – 腋窩リンパ節内の 0.2 mm より大きく 2 mm 未満の腫瘍細胞の領域 (顕微鏡でのみ確認でき、微小転移と呼ばれることが多い)。
- N1 – がんが 1 ~ 2 ~ 3 個の腋窩リンパ節 (または同数の胸腔内リンパ節) に転移しており、最大サイズは 2 mm です。
- N2 – 4 ~ 9 個のリンパ節への癌の広がり:腋窩のみ (N2a)、内部乳腺節のみ (N2b)。
- N3 – がんが 10 個以上のリンパ節に転移しています。腕の下、鎖骨の下、または鎖骨の上のリンパ節 (N3a)。 内乳房または腋窩リンパ節(N3b)へ。 鎖骨上リンパ節 (N3c) が影響を受けます。
遠隔転移の指標:
- M0 – 転移なし。
- M0 (+) – 遠隔転移の臨床的または放射線学的徴候はありませんが、血液または骨髄、または他のリンパ節で腫瘍細胞が見つかります。
- M1 – 他の臓器への転移が確認されます。
乳がんの組織学的分類
現在の乳がんの組織病理学的分類は、腫瘍組織サンプル(生検)の組織学的研究の過程で研究される新生物の形態学的特徴に基づいています。
2003 年に WHO によって承認され、世界中で受け入れられている現在のバージョンでは、この分類には約 24 種類の主要な腫瘍タイプと、ほぼ同数の小さな (よりまれな) サブタイプが含まれています。
乳がんの主な組織型は次のとおりです。
- 非浸潤(非浸潤)がん:乳管内(乳管)がん。 小葉がんまたは小葉がん(LCIS)。
- 浸潤性(浸潤性)がん:乳管(乳管内)がんまたは小葉がん。
欧州臨床腫瘍学会 (ESMO) の統計によると、これらのタイプは悪性乳房腫瘍の臨床症例の 80% を占めています。 他の場合には、あまり一般的ではない種類の乳がん、特に次のような種類の乳がんが診断されることもあります。 管状(がん細胞は管状構造を形成します)。 粘液性またはコロイド状(粘液を含む); 化生(扁平上皮、腺扁平上皮、アデノイド嚢胞、筋表皮); 乳頭状、微小乳頭状); パジェットがん(乳頭・乳輪の腫瘍)など
標準的な組織学的検査プロトコルに基づいて、正常細胞と腫瘍細胞の分化(識別)レベルが決定されるため、乳がんの組織学的分類により、腫瘍の悪性度を決定することができます(これはがんとは異なります)。段階)。 新生物組織の組織病理学的分化のレベルによってその浸潤性増殖の可能性がわかるため、このパラメーターは非常に重要です。
細胞の構造の偏差の数に応じて、グレードが区別されます。
- GX – 組織識別のレベルを評価できません。
- G1 – 高度に分化した腫瘍 (低悪性度)、つまり腫瘍細胞と腫瘍組織の組織が正常に近い。
- G2 – 中程度に分化した(中級)。
- G3 – 低差別化(高グレード)。
- G4 – 未分化(高グレード)。
グレード G3 および G4 は、異型細胞が顕著に優勢であることを示します。 このような腫瘍は急速に増殖し、その拡散速度は G1 および G2 レベルで分化した腫瘍よりも高くなります。

専門家は、この分類の主な欠点は、完全に異なる生物学的および臨床的プロファイルを持つ腫瘍が 1 つのグループに含まれているため、乳がんの不均一性をより正確に反映する能力が限られていることであると見ています。 その結果、乳がんの組織学的分類には予後価値が最小限に抑えられます。
乳がんの免疫組織化学的分類
新しい分子腫瘍マーカーの使用により、エストロゲン (ER) とプロゲステロン (PgR) の腫瘍細胞受容体の発現と、HER2 (細胞増殖を刺激する上皮成長因子 EGFR の膜貫通型タンパク質受容体) の状態が検出され、乳がんの国際分類が登場しました。これにより、予後価値が証明され、治療法をより正確に決定できるようになります。
乳がんの免疫組織化学的分類は、エストロゲンおよびプロゲステロン受容体の活性化により細胞の変化や腫瘍増殖が引き起こされる状態に基づいて、ホルモン陽性腫瘍(ER+、PgR+)とホルモン陰性腫瘍(ER-、PgR-)を区別します。 )。 また、EGFR 受容体の状態は陽性 (HER2+) または陰性 (HER2-) になる可能性があり、これが治療戦略に根本的に影響します。
ホルモン陽性乳がんは、エストロゲンレベルを下げる薬やエストロゲン受容体をブロックする薬を使用したホルモン療法で治療できます。 一般に、そのような腫瘍はホルモン陰性の腫瘍よりも成長が遅くなります。
乳腺科医らは、この種の腫瘍(閉経後に発生することが多く、乳管の内側の組織に影響を与える)を患う患者は短期的には予後が良いが、ER+およびPgR+を伴うがんは長年後に再発する場合があると指摘している。
ホルモン陰性腫瘍は、まだ閉経していない女性で診断されることがはるかに多くなります。 これらの腫瘍はホルモン剤で治療されず、ホルモン陽性のがんよりも早く増殖します。
さらに、乳がんの免疫組織化学的分類ではトリプルポジティブがん (ER+、PgR+、および HER2+) が特定され、ホルモン剤や HER2 受容体の発現を抑制するように設計されたモノクローナル抗体を含む薬剤 (ハーセプチンまたはトラスツズマブ) で治療できます。
また、分子基底サブタイプとして分類されるトリプルネガティブがん (ER-、PgR-、HER2-) は、BRCA1 遺伝子変異を持つ若い女性に典型的です。 主な薬物治療は細胞増殖抑制剤(化学療法)です。
腫瘍学では、乳がんの各分類によって医師が判断できる病気のすべての特徴に基づいて治療法を決定するのが通例です。
ilive.com.ua
乳がん:原因、治療、予後
乳腺の悪性腫瘍は、最も深刻な医学的および社会的問題の 1 つです。 統計によると、乳がんの発生率は非常に高く、世界で合計約 150 万人の女性がこの診断を受けています。 そのうち約 40 万人にとって、この病気は致命的であるため、乳がんのタイムリーな診断と治療が非常に重要です。
乳がん - それは何ですか?
乳がんは、乳房の腺組織で発生する一般的ながんです。 この病気は 13 歳以上の女性と男性の両方に影響します。 病理学的プロセスは、右、左、または両方の乳房の 1 つの葉で、または一度に複数の葉で発生する可能性があります。乳がん統計
毎年、世界中で 125 万人を超える新たな乳房の悪性病変が診断されています。 ロシアだけでも、そのような症例は年間5万4千件発生しており、さらに多くの国で発生率が増加する傾向にある。 これにはいくつかの理由があります。 まず第一に、診断技術が向上し、マンモグラフィ検査が開始されたためです。 これにより、まだ症状が現れていない初期段階で腫瘍を検出することが可能になります。 医師は乳腺科医を訪問し、定期的に検査を受けることを勧めています。 定期的に乳腺の自己検査を行うことも必要です。 この統計は残念なもので、女性の 8 人に 1 人が遅かれ早かれこの深刻な病気に直面します。 この病気は男性にも発生する可能性がありますが、これはまれな出来事です。 研究者によると、病気の男性と女性の比率は約 1:100 です。 乳がんを発症するリスクは時間の経過とともに増加します。 この診断を受けた女性の大多数 (77%) は 50 歳以上の年齢層に属します。乳がんに苦しむ女性の中に若い女の子はほとんどいません (約 0.3%)。
ICD-10 による乳がんコード
C50 乳房の悪性疾患。 C50.0 乳首と乳輪。 C50.1 乳腺の中央部分。 C50.2 上部内側象限。 C50.3 劣った内側象限。 C50.4 上部外側象限。 C50.5 外側下部四分円。 C50.6 腋窩領域。 C50.8 上記のゾーンの複数に広がる。 C50.9 ローカリゼーションが指定されていません。 D05.0 上皮内小葉癌。 D05.1 上皮内乳管内癌。ステージ別の乳がんの詳細な分類 (TNM) およびその他の分類については、当社の Web サイトで説明されています。

乳がんの原因
この病気の病因は完全には解明されていません。 特定の病因はまだ発見されていません。 悪性プロセスの発症には、環境の不利な影響や女性のライフスタイルさえも一定の役割を果たします。 しかし同時に、この病気の症例のうち既知の要因と関連している可能性があるのは 50% にすぎません。リスクのあるグループ
現代医学では、乳がんの次のリスクグループが特定されています。
低リスクグループ(1~2倍高い)。 これには、幼い頃、特に最初の妊娠前に COC を使用した女性が含まれます。 HRT は約 35% 増加します。 このグループには、最初の妊娠の中絶歴のある女性や、血漿エストロジオールレベルを上昇させる脂肪分の多い(飽和した)食事の女性も含まれます。
中リスクグループ(2~3倍に増加)。 主な要因としては、初産が遅い、初経が早い、閉経が遅い、過去に他の種類の癌にかかった、アルコール乱用、不妊、体重増加、乳房の増殖現象、閉経後の肥満などが挙げられます。
高リスク群(4倍以上増加)。 このカテゴリーには、50歳以上の女性と、一親等の親族がこの診断を受けた女性が含まれます。 また、過去に乳がんを患ったことがある女性、放射線被曝後、または異型性を伴う増殖性乳房疾患を患った女性でもリスクが高まります。 重大な要因は、BRCA1、BRCA2 遺伝子の変異です。
遺伝性乳がん
場合によっては「遺伝性がん」と診断されることもあります。 設定の基準は次のとおりです。
若くして病気が発症。 2 つの乳房に腫瘍が発生。 この患者には、乳がんを克服した第1親等および第2親等がいる。 患者および/または親族の新生物の複数の性質。 特定の腫瘍関連の存在。

現在までに、科学者は悪性プロセスの素因に関与するいくつかの遺伝子を特定することができました。 これらは、遺伝子 BRCA1、BRCA2、p53、PTEN です。 最後の 2 つは、カウデン症候群およびリー・フラウメン症候群に対する家族および個人の素因の原因となります。 研究によると、遺伝性乳がんの症例の最大 40 ~ 70% は BRCA1、BRCA2 遺伝子の変異と関連しています。 これらの突然変異の保有者は、1つの腺で悪性プロセスが発生するリスクが非常に高く、最大80%であることが判明しました。 そして、第二の乳房に腫瘍が発生するリスクは50〜60%です。 (一般人口では、これらの数字は 2 % と 4.8% です)。 BRCA1 変異の保因者では、発生率のピークは 35 ~ 39 歳であり、BRCA2 遺伝子変異は 43 ~ 54 歳で起こります。 BRCA2 変異を持つ患者の予後は、散発性がんや BRCA1 変異を持つ患者よりも良好であることは注目に値します。 突然変異を伴う妊娠や出産は、防御因子ではないことが判明した。 したがって、突然変異を持って出産した女性は、出産していない女性よりもさらに頻繁に(約1.7倍)40歳未満でがんを発症します。 さらに、その後の妊娠ごとにリスクは増加します。 遺伝子変異が検出された場合は、治療を再検討する必要があります。
そのような女性の扱いには次のような特徴があります。
臓器温存手術は行っておりません。 予防のために乳房切除術を受けることをお勧めします。 化学療法の適応は拡大しています。 BRCA1 変異の場合、予防のために卵巣摘出術が推奨されます。
乳がんの発生メカニズム
現在まで、乳がんの病因は十分に研究されておらず、腫瘍プロセスの進行のすべての段階が正確に定義されていません。 現代医学では、病気の発症における 3 つの主要な段階、つまり発症、促進、進行を区別するのが通例です。 発がん(悪性腫瘍)は、がん原遺伝子の変異の結果として始まります。 それらは癌遺伝子に変化し、細胞の成長を促進します。 (変異原性成長因子の形成が増強されるか、細胞表面受容体が影響を受けます)。 細胞が損傷すると、エストロゲンは損傷が修復されるまでその細胞の複製を促進します。 エストロゲンは腫瘍の進行に必須の因子であり、プロモーション期間中に腫瘍の進行をサポートします。 血管新生が始まると、遠隔転移が現れます。 これは、病気の臨床症状が現れる前、最初の 20 回の倍加中にさえ発生します。 悪性乳房腫瘍は、乳腺のどの部分でも、分泌細胞 (乳細胞) から肺胞に形成される可能性があります。 乳頭付近の円柱上皮または非角化重層扁平上皮の排泄管内。一般に、乳がんに関する情報は現在、B. Fisher の仮説によって提示されています。
播種は無秩序です。つまり、悪性細胞の播種には厳密な順序がありません。 - 悪性細胞は塞栓形成を通じて所属リンパ節に侵入しますが、このバリアは機能しません。 - 悪性細胞が血流を介して体中に広がることは、腫瘍の播種にとって非常に重要です。 - 手術可能な乳がんは全身疾患です。 - 手術の選択肢が患者の生存に影響を与える可能性は低いです。 - リンパ節に影響を受けていない患者の最大 25%、所属リンパ節に影響を受けている女性の約 75% が遠隔転移により 10 年以内に死亡します。 - 乳がんの場合、全身的な治療効果をもたらすには追加の方法が必要です。
乳がんの症状
この病気では、臨床像が異なる場合がありますが、これは腫瘍プロセスの段階によるものです。 したがって、触知できない新生物では、臨床徴候は観察されません。 腫瘍が成長し続けると、乳がんの典型的な像が観察されます。これについては、身体検査について説明するときに説明します。
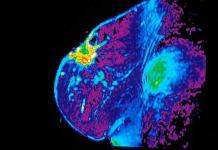
乳がん:写真




乳がんの診断
履歴を取る
乳がんの診断は、患者の病歴を調べることから始まります。 この場合、病気の最初の症状がいつ現れたのか、そしてどのような順序で変化が起こったのかを調べる必要があります。 つまり、腫瘍増殖の動態、乳頭、乳輪、乳房皮膚の病理学的変化、所属リンパ節の肥大を分析します。 医師は、患者が過去に乳房損傷や外科的介入を受けたことがあるかどうかも知っておく必要があります。 さらに、過去 8 か月以内に肝臓、骨、肺 (遠隔転移が最も頻繁に発生する領域) の病気の治療を受けたかどうかを尋ねる必要があります。乳腺の検査と触診
身体検査は診断において重要な役割を果たします。 検査中は、乳腺の形状に注意を払い、乳汁の状態、ハロー(収縮、潰瘍が疑われる)を評価します。 皮膚の状態を評価することも必要です。 がんの可能性の兆候は、皮膚の発赤、腫れ、転移の存在です。 典型的な兆候は、真皮のリンパ浮腫によって引き起こされる、いわゆる「オレンジピール」です。 重要な診断兆候は、腫瘍上の皮膚が硬くなる「プラットフォーム」症状です。 「臍帯化」は、クーパー靱帯の浸潤の結果として皮膚が引っ込むときに発生することがあります。
触診は、サイクルの最初の段階で最も有益です。 この方法により、腫瘍の存在を検出するだけでなく、その大きさを推定することも可能になります。 また、触診の助けを借りて、リンパ節の状態を研究し、病気の段階を示唆することもできます。 がん発生の後期段階では、検査がおそらく最も有益な診断方法であると考えられています。 この段階では、皮膚の腫れ、組織浸潤、乳房の皮膚への腫瘍の増殖が観察されます。 癌性腫瘍が移行ひだの領域に位置する場合、X線検査ではそれが明らかにならない場合があります。 このため、視診と触診が診断において非常に重要です。 触診と検査では、周期の最初の段階 (5 ~ 10 日目) に最も正確な結果が得られます。 しかし、結果が出ないこともあります。 私たちは直径が1cmに達しない触知できない腫瘍について話していますが、これらの方法を使用して所属リンパ節の状態を正確に評価することも不可能であることも考慮する必要があります。
臨床検査
患者の状態の動的なモニタリングに関しては、腫瘍マーカー (CA 153、癌胎児性抗原、組織ポリペプチド抗原) の研究が非常に重要です。器楽的手法
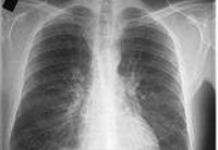
マンモグラフィー
特に高齢層の患者を検査する場合の主な診断方法はマンモグラフィーです。 このような診断の感度は非常に高く、95%に達します。 この助けを借りて、腫瘍の直径を正確に決定したり、場合によっては所属リンパ節の状態を研究したり、触診では判断できない腫瘍節を検出したりすることができます。
乳管造影
乳管内腫瘍が疑われる患者には、乳管造影検査が必要です。 腫瘍の直径を正確に評価するだけでなく、乳頭からの距離も示すのに役立ちます。肺嚢胞造影
別の有益な方法は、肺嚢胞造影法です。 その助けを借りて、空洞形成の内部構造が視覚化されます。乳腺の超音波検査
超音波はマンモグラフィーとは競合しない一般的な診断方法です。 これにより、原発腫瘍のサイズをより正確に評価し、その構造と概要を研究し、血液供給の性質を特定することができます。 超音波法の最も重要な特徴の 1 つは、所属リンパ節を検査できることであり、これにより診断を明確にすることが可能になります。MRIとX線CT
悪性乳房腫瘍の診断に CT および MRI が使用されることはほとんどありません。 これらの方法は高価であり、特異性や精度もそれほど高くありません。生検
形態学的検査により乳がんの診断が完了します。 その結果は、治療コースを開始する前に取得する必要があります。 研究用の材料は穿刺吸引生検の方法を使用して採取されます。 次に、細胞の生物学的および形態学的パラメーターが研究されます。 この診断の感度は 98% です。 腫瘍の進行は本質的に常に全身性であることを考慮して、医師は肝臓、骨、肺などの状態を研究し、患者に包括的な診断を処方します。
乳がんの鑑別診断
結節性乳がんは結節性乳腺症、乳房嚢胞、パジェットがんは乳頭腺腫と区別する必要があります。 浮腫性浸潤癌の鑑別診断も非常に重要です。 丹毒や乳房炎とは区別する必要があります。
正確な診断を下す際には、腫瘍の発達の方向と腺の四分円を考慮する必要があります。 増殖の形態(びまん性または結節性癌)、腫瘍の直径、隣接組織の状態、影響を受けたリンパ節の存在、および検出可能な遠隔転移も考慮されます。 診断 T2N1M0 (II B 度) の定式化の例を示します。 これは、腫瘍の直径が最大 5 cm で、腋窩リンパ節に単一転移 (最大 3 つ) があることを意味します。 遠隔転移は検出されなかった。
乳がんの治療
乳がんやその他の悪性腫瘍は民間療法では治療できません。 治療なしで治癒する信頼できる例は一つもありません。 医療の提供が日常的に遅れると、病理学的過程が広がり、死に至る可能性があります。
乳がんの治療戦略
患者の治療方針を決定する際には、次の予後要因が考慮されます。
原発腫瘍のサイズ。 - 所属リンパ節における悪性細胞の存在。 - 組織学に基づく悪性度。 - 受容体の状態。 腫瘍細胞における ER および (または) PR の検出は、腫瘍が高度に分化していることを示します。 ホルモン治療に対する腫瘍細胞の感受性は、細胞膜上の ER および PR の発現に大きく関係しています。 女性の年齢層が異なると、ERとPRの内容が異なります。 したがって、ERおよびPRは閉経前の患者の45%、閉経後の患者の63%に見られます。 ホルモン療法の目標は、腫瘍細胞に対するエストロゲンの影響を軽減することです。 腫瘍がホルモン依存性である場合、その成長は遅くなります。 - DNA合成活動。 それは次の指標によって判断できます: 異数性腫瘍の DNA の数。 細胞周期のS期にある細胞の割合。 Ki67 過剰発現、倍数性、チミジンキナーゼ活性。 Ki67 は、新生物の増殖能力を特徴付ける特別なマーカーの指定です。 この核内抗原は、G0 を除く細胞周期のどの段階でも発現します。 したがって、それは細胞集団の成長のマーカーです。 成長因子受容体または成長調節因子 - EGFR; HER2/ノイ。 膜貫通型糖タンパク質 HER2/neu はチロシンキナーゼ受容体です。 それが刺激されると、転写機構が誘発され、細胞の成長と増殖が加速されます。 実験モデルを用いた研究により、Her2/neu が内分泌および化学療法に対する腫瘍耐性の原因である可能性があることが確認されています。 血管内皮増殖事実 VEGF は内皮細胞の増殖と遊走を促進します。 しかし同時に、これらの細胞のアポトーシス(破壊)を阻害します(腫瘍の進行と転移巣の出現は血管新生に関連しています)。 血小板によって分泌される内皮増殖因子は、機能および構造においてチミジンホスホリラーゼと類似しています。 これは、チミジンからチミンと2デオキシリボース1リン酸への逆脱リン酸化を触媒する酵素です。 その過剰発現は急速な腫瘍増殖を促進し、視視低下によって誘発されるアポトーシスに対する細胞の耐性を高めます。 癌遺伝子 BRCA1、BRCA2。 他の生物学的要因は現在積極的に研究されています。 まず第一に、これは Bcl2、p53、PTEN、CDh2、MS h3、ML h2、ALCAM/CD166 に関するものです。 Bcl2 は、かなり多様なタンパク質ファミリーです。 Bcl2 や BclXI などの一部は、アポトーシス誘導因子やシトクロム C の放出を阻害するため、アポトーシスを遅らせます。 同時に、他のタンパク質 (Bad と Bax) は逆の効果をもたらします。 アポトーシスの加速を引き起こします。 DNA 構造に損傷が生じると、p53 タンパク質がアポトーシス機構を活性化します。 これにより、損傷した遺伝装置を持つ細胞の再生が妨げられます。 正常な p53 は急速に分解する傾向があることが知られているため、核内での p53 の存在を確認することは非常に困難です。 変異体 p53 はアポトーシスを防止し、細胞が化学療法や放射線治療に対して耐性を持つようにします。
乳がんの治療法
治療計画の段階では、外科医、放射線療法士、化学療法士の専門分野の医師で構成される相談を受けることをお勧めします。 すべての患者にとって、複雑な治療法の一環として卵巣摘出術を行う前に、卵巣の転移性病変を除外するために婦人科医の診察を受けることが必須です。 乳がんの複雑な治療には、いくつかの方法を組み合わせて使用する必要があります。 局所治療(手術、放射線療法)と全身治療(ホルモン療法、化学療法)の組み合わせが必要です。 これにより、患者の治癒、または少なくとも安定した寛解を達成することが可能になります。 悪性プロセスを排除できない兆候が女性に検出された場合、入院が必須です。非薬物療法による治療
主な非薬物療法は放射線療法です。 放射線被ばくは通常、独立した治療法としては使用されません。 これは、乳腺悪性腫瘍患者の複雑な治療法の一部です。 放射線は、薬物療法の有無にかかわらず、保存的外科手術後の補助治療に使用されます。 予後に影響を与える好ましくない要因がある場合、根治術後にも使用されます。 腫瘍が内部に局在している患者の場合、胸骨傍領域への放射線被曝が必要となります。 3つ以上のリンパ節が影響を受けている場合、つまりリンパ系に顕著な転移がある場合、リンパ管の局所領域が照射されます。 放射線治療はさまざまな時期に開始されます。 場合によっては、手術直後に治療が行われ、その後投薬治療が行われることもあります。 他の場合には、放射線照射は薬物治療と同時に、または薬物治療後に行われますが、手術後6か月以内に行われます。 がんの保存的治療では、放射線療法と化学療法またはホルモン剤が併用されることがよくあります。 この治療法は、外科的方法を使用する複雑な治療法に代わるものではありません。 複雑な治療を受けた患者は、5年生存率および10年生存率が高くなります。 しかし、場合によっては、一部のカテゴリーの患者(高齢者や他の病気を患っている)にとっては手術が不当に危険である可能性があるため、保守的なアプローチを選択しなければならないことがあります。 したがって、がん患者に対する現代の治療は包括的なものでなければなりません。 治療は、悪性プロセスの段階とその性質を考慮して処方されます。 付随する病状や年齢を考慮した、各患者への個別のアプローチも非常に重要です。乳がんの治療薬
化学療法は、ほとんどのがん治療プログラムの重要な要素です。 その実施の適応は、病気の特定の段階だけでなく、好ましくない予後因子でもあります。 これらの要因には以下が含まれます: - 新生物の直径が 2 cm を超える - 年齢が 35 歳未満。 - II ~ IV の悪性度。 - 受容体陰性。 - リンパ節への転移性損傷。 - HER2/neu の過剰発現。 現在、医師は幅広い選択肢の化学療法薬を自由に使用できます。 腫瘍進行のリスクが高い患者には、CMF(シクロホスファミド、メトトレキサート、5フルオロウラシル)、AC(アドリアマイシン、シクロホスファミド)、FAC(5フルオロウラシル、アドリアマイシン、シクロホスファミド)などの抗がん剤、またはアントラサイクリンとタキサン(AT)の組み合わせが適応となります。 このアプローチが患者の生存にプラスの影響を与えることが証明されています。 手術可能な形態のがんの場合、手術前の化学療法は補助化学療法と比較して生存率を改善しません。 しかし、腫瘍のサイズを縮小するのに役立ち、プロセスが局所的に進行した場合に臓器温存介入を実行することが可能になります。 化学療法コースにトラスツズマブやベバシズマブなどの薬剤の使用を組み合わせると、さらに大きな治療効果を達成できます。 独立したコースとしてのホルモン治療はほとんど使用されません。 しかし、場合によっては(高齢女性の受容体陽性腫瘍)、長期寛解につながります。 ホルモン療法は、ステロイドホルモン受容体を有する腫瘍患者の複雑な治療において最大の効果を示しています。がんのホルモン治療には 2 つの方向性があります。
- 悪性細胞の制御に関してエストロゲンと競合する薬剤の使用。 - エストロゲンの生成を減少させる薬の使用。 作用機序によれば、最初のグループには抗エストロゲン薬が含まれます。 補助療法に選択される薬剤はタモキシフェンです。 細胞内の受容体をめぐってエストロゲンと競合します。 さらに、S 期の細胞数が減少し、G1 期では細胞数が増加します。 2 番目のグループの薬剤には、アロマターゼ阻害剤が含まれます。 これらの物質の作用機序は次のとおりです。エストロゲンの生成に関与する酵素の阻害が起こり、これにより内因性エストロゲンの含有量が減少します。 最も特異的なのはレトロゾールとアナストロゾールです。 これら 2 つの薬剤は、アンドロステンジオンとテストステロンからそれぞれエストロンとエストラジオールへの変換を阻害することができます。 両方のグループの薬剤は非常に効果的であり、乳房腫瘍のホルモン治療の第一選択として広く使用されています。乳がんの治療法としての手術
乳房腫瘍の外科的治療にはいくつかの選択肢があります。
胸筋を温存する根治的乳房切除術。 この手順は標準です。 この後、一次乳房形成術を実行できます。

乳輪温存乳房切除術。 この介入の後は、形成手術も可能です。
臓器温存手術とその後の放射線治療。
放射線および薬物治療と組み合わせた腫瘍切除術。 この方法は、上皮内乳管内癌患者の治療に使用されます。 このような場合にはセンチネルリンパ節を検査する必要があります。 一部の患者は術中放射線照射(線量20Gy)を受けます。
長年の医療現場では、外科手術の量を増やしても患者の生存率にプラスの影響を及ぼさないことがわかっています。 根治的乳房切除術は、プロセスが局所的に進行している場合、または腫瘍が中心に位置している場合に行われます。 手術中に、繊維が除去されます(腋窩および筋肉間、鎖骨下および肩甲下も)。 胸筋は保存されています。 侵襲性が低いため、合併症(痛み、神経痛、静脈不全、リンパうっ滞)の可能性が低くなります。 精神的外傷を防ぐために、一期乳房形成術が行われます。

乳がんステージ1でも、ステージ2aでも乳房温存手術が可能です。 場合によっては、ステージ 3 の乳がん(放射線療法と化学療法後)でも乳房を温存できる場合があります。 臓器温存介入は、患者の精神状態と生活の質にプラスの効果をもたらします。 高齢女性の腫瘍切除術とその後の放射線療法およびホルモン療法は、全体の無病生存率に大きな影響を与えません。 現代医学は、再建的介入を複雑な治療における重要な段階とみなしています。 乳房形成術の目的は、女性の精神的・感情的状態の悪化を防ぐことです。 この手順は、最初に実行することも、遅延して実行することもできます。
乳房手術
胸の形とボリュームを復元するには、現在 2 つの方法が使用されています。
内部人工器官。 - 自己組織を使用した再建。 手術不可能な局所進行がんまたは転移がんの場合、緩和手術が行われることがあります。 腫瘍の崩壊と出血を伴う患者に適応されます。 この場合、次の規則が遵守されます。 - 患者に遠隔転移がなく、まだ治療の見込みがある場合、手術は根治的に実行される必要があります。 「補助療法は、局所進行腫瘍の患者の治癒に役立つ可能性が高く、遠隔転移のある患者の命を何年も延ばすことができます。 治療を受けた女性は、2年間にわたって6か月ごとに包括的な診断を受けなければなりません。 その後は年に1回検査を受けます。
乳房切除後の整形手術(前後の写真)



乳がんの生存予後
現在までに、医師は乳がんの治療において大きな進歩を遂げてきました。 しかし、最良の結果は病気の初期段階で得られます。 これは、がんの早期発見が主な有益な要素であることを意味します。
乳がんステージ 1: 生存予後
ステージ 1 の乳がんは、腫瘍サイズが 2 cm までと小さいのが特徴で、5 年の予後は 75 ~ 95%、10 年の予後は 80% です。乳がんステージ 2: 生存予後
ステージ 2 の乳がんは、腫瘍サイズが最大 5 cm であることを特徴とし、近隣のリンパ節に転移する可能性があり、5 年余命は 50 ~ 80%、10 年余命は 40 ~ 60% です。乳がんステージ 3: 生存予後
ステージ 3 の乳がんは、腫瘍サイズが 5 cm を超える大きな特徴があり、周囲の組織やリンパ節が影響を受け、5 年余命は 50% 以下、10 年余命は最大 30% です。乳がんステージ 4: 生存予後
ステージ 4 の乳がんは、さまざまな大きさの転移があり、5 年生存率は 10% 未満、10 年生存率は最大 5% です。予防策
乳房腫瘍を予防する方法はまだ開発されていません。 出産には予防効果があることが知られています。 30歳を過ぎて初めて母親になった女性は、20歳未満で出産した女性に比べて乳がんを発症する可能性が2~3倍高いが、これは遺伝子変異の存在には当てはまらない。 女性が突然変異した遺伝子を持っている場合、妊娠や出産に関係なく、どの年齢でも病気になる可能性があります。BRCA IおよびII遺伝子変異の場合、予防目的で両側乳房切除術および卵巣切除術が行われます。 したがって、悪性プロセスが発生するリスクは 90% 以上削減できます。
マンモグラフィーとは何か、どのように行われるか、結果の解釈
乳がんの早期診断のための予防基準に乳房マンモグラフィーが含まれており、40歳になったらすべての女性に検査が義務付けられています。
乳腺の超音波検査の詳細:正常、経過、結果の解釈
乳腺の超音波検査は変化を診断する良い方法です。 また、超音波検査は痛みが全くなく、体に害を与えることはありません。 あらゆる準備
乳頭分泌の詳細
乳首からの分泌物を発見すると、ほとんどの女性は深刻な病気を疑ってパニックになり始めます。 実際、多くの場合、この現象は症状ではありません。
乳腺症:その正体、治療法と薬
乳房症は、ホルモンレベルが乱れた女性によく見られる病気で、月経周期の半ばに乳房の痛みが現れるのが特徴です。
びまん性乳腺線維腺腫症の治療の詳細 
女性の胸を大きくするためのホルモン剤
2018 女性の健康に関するブログ。
乳腺症コード (ICD 10 N60) は、資格のある治療を必要とする重篤な病状です。
乳腺線維嚢胞性乳房症 (ICD 10 コード N60.1) および類似の疾患は、国際疾病体系化第 10 版によってコード化されました。 この分類は世界中の専門家によって使用されています。 そのおかげで、死亡例も含めた統一された公式統計が維持されています。
- 原因
- 症状
原因
この病気は良性起源のものです。 その主な原因は、女性の体内でエストロゲン(男性ホルモン)が過剰に生成され、プロゲステロン(女性ホルモン)が不足しているためです。 その結果、結合組織型の形成、乳管および肺胞上皮の増加が観察されます。 これらすべては局所的または拡散的に起こります。 これに伴い、乳汁の生成に関与するホルモンであるプロラクチンの増加が観察される場合があります。

女性が子供を期待していない場合も、乳首から白っぽい分泌物が出ることがあります。
乳腺の機能に障害があると、がんなどの危険な病気の発症を引き起こす可能性があります。
乳腺症 (ICD 10 N60) の最も一般的な原因は次のとおりです。
- 乳房の炎症過程。
- 遺伝的素因;
- 個人的な妊娠中絶。
- ミルクが利用できる場合、赤ちゃんに母乳を与えることを嫌がります。
- 心理的問題(ストレス、過労、うつ病、神経疲労)。
- 肝不全または腎不全。

- 婦人科疾患。
- 閉経が遅い。
- 初期の性的経験。
- 甲状腺疾患;
- 過体重、高脂血症。
- 糖尿病;
- 妊娠後期。
これは、嚢胞性乳腺症などの病気の発症に影響を与える要因の小さなリストです。 この問題を扱う医療専門家のみが詳細な情報を提供できます。
症状
第10分類の線維嚢胞性乳腺症は2つのサブタイプに分けられます。 線維嚢胞性乳房症は結合組織の増加を特徴とし、その嚢胞性形態は新生物の出現を特徴とします。 初期段階ではそれらは非常に小さいため、特殊な機器の助けを借りてのみ見ることができます。

時間が経つにつれて、嚢胞は非常に大きくなり、患者の乳房が変形することもあります。 病気が結節性の場合は、リンパ節の拡大が観察されます。
乳腺症の症状 (ICD 10 コード N60):
- 触診中に圧縮が感じられます。
- 特定の緑色がかった分泌物が乳首から現れます。
- 乳腺に痛みを伴う感覚があります。
- 乳房の肥大が起こる可能性があります。
- 月経周期の後半になると乳腺が厚くなります。 これは静脈血の停滞によるものです。
すべての結果を比較し、全身状態を評価し、嚢胞性乳腺症またはその線維嚢胞性タイプがどの段階にあるのかを評価した後にのみ、専門家は必要な治療法を処方します。
治療および予防措置
しかし、FCM は良性ですが、それを背景に癌が発生することがよくあります。 専門家にタイムリーに連絡することで、線維嚢胞性乳房疾患を初期段階で診断し、可能な限り効果的な治療を行うことができます。
この場合、医師はホルモン、ホメオパシー物質、ビタミン、ミネラルの摂取に加え、民間療法の使用も含む包括的な治療法を処方します。 破壊的な習慣をやめ、睡眠パターンを正常化することが不可欠です。 このアプローチにより、人体が自ら積極的に病状と戦うことが可能になります。
女性の適切でバランスの取れた栄養には特に注意が払われています。 最適に強化された食品はホルモンレベルにプラスの効果をもたらし、ホルモンレベルを安定させ、人体のすべてのシステムと器官の活動を正常化するのに役立ちます。 抗酸化物質の存在は、嚢胞の悪性型への変化に対処します。

嚢胞性乳腺症は、ホルモンの不均衡の原因が特定され、それが中和されれば治癒する可能性があります。 上記の方法は、医師の処方箋をすべて守り、厳密に従った場合に効果的です。 より重度の場合、より穏やかな方法では望ましい結果が得られない場合には、外科的処置が処方されることもあります。
線維嚢胞性乳腺症の存在について懸念がある場合、女性はすぐに腫瘍学者、乳腺科医、婦人科医に相談する必要があります。 特に30年後、公正なセックスのすべての代表者にとって、体系的に婦人科医を訪問する必要があります。
線維嚢胞性乳腺症から身を守るには、次の予防措置を実践する必要があります。
- 健康的な「食事」に注意を払います(すべての有害な食品、アルコール飲料を排除し、より多くの穀物、果物、野菜を食べます)。
- 合成繊維の圧縮下着を着用しないでください。 あなたのワードローブには天然素材で作られたブラジャーが必要です。
- 自分の体重を安定させます。
- 心理的健康を維持します。悪い感情は最小限に抑え、ポジティブな感情は最大限に保ちます。
gormonys.ru
線維嚢胞性乳腺症の分類と治療へのアプローチ
国内の分類によれば、線維嚢胞性乳腺症はびまん性と結節性の形態に分類されます。
どちらのタイプの病気も同様の症状を示しますが、結節性疾患の場合は、乳房組織の痛みに加えて、触診でさまざまなサイズの密集した移動性結節が検出されます。
国際疾病分類 X 改訂版では、線維嚢胞性乳腺症は良性乳房異形成 (N 60) の項目として考慮されています。

- 医師が早く効果的に妊娠する方法を教えてくれました! 消される前に見てね…
2 発生原因
線維嚢胞性乳腺症の形成の素因となる要因:
- 晩産(30歳以降)またはその欠如。
- 3回以上の人工中絶。
- 授乳期間が短い。
- 定期的な性生活の欠如。
- 相対的または絶対的な高エストロゲン症(エストロゲンレベルの増加)。

3 診断と治療
胸の痛みを感じた場合は、医師(乳腺科医、腫瘍医)に相談し、検査を受ける必要があります。 ロシアでは、線維嚢胞性乳腺症は良性の病状であるにもかかわらず、婦人科医ではなく腫瘍医によって治療されています。 必要な検査リスト:
- 乳房の検査と触診。
- 乳房の超音波検査。
- マンモグラフィー;
- 穿刺生検。

乳腺の変化を視覚化するために、超音波検査(40歳未満)またはマンモグラフィー(40歳以降、必要に応じてそれより若い年齢で)が実行されます。 結節形成が特定された場合は、得られた材料を検査しながら超音波制御下でそれらを穿刺することをお勧めします。 これは新生物の悪性性質を排除するために必要です。
病気の治療はその形態によって異なります。 結節性乳腺症の場合は、形成物を除去するために外科的介入が行われます。 びまん性型の場合は保存的治療が必要です。 治療の基本はホルモン剤の使用です。 現在最も人気があるのは、天然プロゲステロンをベースにした外用製品(プロゲストゲル、クリノン)です。
klimakspms.ru
乳がん:ICD-10コード、病期および治療法
乳がん (BC) の話題に興味のある読者の皆様を、私たちのウェブサイトへようこそと歓迎します。 今日、これは最も研究され研究されている種類の腫瘍学の 1 つです。 私たちの記事はこの深刻なテーマに焦点を当てています。
この病気が何であるか、国際分類子によってどのようにコード化されるか、そして病理学的プロセスがどのように進行するかを見ていきます。
がんの概念
乳がんの場合、ICD-10 コードは C50 です。 このグループには、SAH ゾーン (乳輪 + 乳頭)、腺の中央部およびそのさまざまな象限に発生する腫瘍が含まれます。 C50.8 が指定された制限を超える病変をコード化する方法を含みます。
がんとは、乳房の腺組織に影響を及ぼす悪性新生物のみを指します。 WHOによると、これは「女性」がんの最も一般的な形態であり、13歳からの少女が罹患し、90歳までの成人女性に発症します。
病気の原因
今日までそれらは不明です。 発がん性因子のどれも、この病気の発症に確実に関連しているとはまだわかっていません。 このタイプのがん病理の発症に寄与する要因は次のように考えられます。
- 月経の早期開始(12歳以前)。
- サイクルの混乱。
- 妊娠がないこと、特に出産と授乳に終わるもの。
- 授乳障害;
- 閉経が遅い(55年以降)。
- ホルモン剤の長期使用。
- アルコール乱用、喫煙。
- HD とアテローム性動脈硬化。
- 内分泌疾患(過体重、糖尿病);
- 生殖器がんの病歴;
- 血縁者に乳がんが存在する。
 乳がんの発症とBLV(牛白血病ウイルス)の人体への侵入との間に関連性があることが確認されています。 さらに、この要因は、おそらく上に挙げたすべての従来の要因よりも重要です。 ウイルス自体ががんを引き起こすのか、それとも体内に存在するがん細胞の増殖を引き起こすのかは不明です。
乳がんの発症とBLV(牛白血病ウイルス)の人体への侵入との間に関連性があることが確認されています。 さらに、この要因は、おそらく上に挙げたすべての従来の要因よりも重要です。 ウイルス自体ががんを引き起こすのか、それとも体内に存在するがん細胞の増殖を引き起こすのかは不明です。
しかし、乳汁分泌の一部を担う乳汁分泌タンパク質ELE5が、がんの発生中に腫瘍増殖部位への免疫細胞の欲求を刺激し、この領域での新しい血管の発芽を刺激することが知られるようになった。 これは腫瘍を破壊するのではなく、腫瘍の成長を助けます。
将来の発見は、この病気の革命的な治療法の発見につながる可能性があります。 現時点では手術が主な方法と考えられています。
TNM の分類と病期
腫瘍はその有病率に応じて次のように分類されます。
- プライマリ (T);
- 所属リンパ節の損傷を伴う (N)。
- 遠隔転移の存在 (M)。
原発腫瘍は非常に小さく、周囲の組織への浸潤がない場合があります。 これはいわゆる上皮内がんであり、「Tis」と表示されます。 このグループには、乳管癌および小葉癌、パジェット病が含まれます。
大きな腫瘍を段階別に分類します。 病気の4つの主要な段階を区別するのが通例です。
- T1 - 新生物は 2 cm に達せず、転移せず、周囲の組織に成長しません。
- T2 (a) - このグループには、周囲の組織に成長する最大 2 cm の腫瘍が含まれます。 または、局所的だがより大きな新生物(直径 2 ~ 5 cm)。
- T2 (b) - 腫瘍は 5 cm を超えませんが、所属リンパ節に転移しています。
- T3 (a) - 新生物は 5 cm 以上に成長し、胸部の筋肉にまで成長する可能性があります。 この段階は、乳頭からの分泌物(茶色、血性)、皮膚の潰瘍の出現、乳房の形状の変化、乳頭の引っ込み、「レモン皮」症候群、患部の組織の腫れを特徴とします。 。 局所転移はありません。
- T3 (b) - 腫瘍のサイズは同じままですが、胸骨傍、腋窩、鎖骨下のリンパ節に転移が検出されます。
- T4 - このグループには、周囲の組織への増殖、結節や潰瘍の形成を伴う皮膚への播種を伴う場合、あらゆるサイズの腫瘍が含まれます。 病理学的過程のこの段階では、がんは第二乳腺に広がり、近くの臓器だけでなく他の臓器やリンパ節にも影響を及ぼします。
 プロセスは最終段階に入ります。 この発症段階では、この病気は事実上治療不可能です。
プロセスは最終段階に入ります。 この発症段階では、この病気は事実上治療不可能です。
乳がんの兆候
残念ながら、上皮内がんの場合は症状がほとんどありません。 パジェット病を除いて。 その症状は乾癬や湿疹に似ています。
乳がんの最初の兆候には、触知できる腫瘤が含まれます。
- 可動式。
- 実質的に痛みはありません。
- 小さな直径。
腫瘍プロセスの進行に伴い、新生物は腺組織に固定され、その可動性が損なわれます。 乳腺の体積が変化し、変形し、成長中の組織上の皮膚が腫れ、赤くなり、剥がれ落ちます。 乳首から分泌物が現れ、最初はピンク色で緋色の縞模様があり、次に茶色になります。
同様の症状(特に初期のもの)は、乳管内(乳管内)乳頭腫でも発生することがあります。 腫瘍は良性ですが、悪性化する傾向があります。 乳頭形成の特徴的な違いは、シールを押すと腫瘍のサイズが小さくなり、乳頭から浸出液が放出されることです。
病気の診断
診断を行う場合、検査は腺の触診と検査から始まります。 受け入れられるハードウェア方式は次のとおりです。
- さまざまな種類のマンモグラフィー。
重篤な疾患を確認するには、組織の生検および細胞学的検査が行われます。 
処理
主な治療法は手術です。 臓器温存法が使用され、小さく限られた非転移性腫瘍の部分切除と、影響を受けた腺の完全な除去(乳房切除術)が行われます。 乳房の部分切除は通常、放射線療法によって補完されます。 切除後、転移がない限り、多くの場合、この病気は再発しません。
親愛なる読者の皆さん、新しい記事が出るまでこれでお別れです。 当社の Web サイトにアクセスして新しい情報を入手し、ソーシャル ネットワークを通じて友人と共有してください。
krasivayagrud.ru
ICD 10 に基づく乳がんコード化
女性の乳房の腫瘍学的プロセスは、特に 40 歳以降または閉経期の始まりに非常に一般的です。
- 病因
- ローカリゼーションの種類
世界中で、ICD 10 の乳がんは C50 でコード化されていますが、これには腫瘍性皮膚疾患 (C43.5 ~ C44.5) として分類される乳房の皮膚のがんは含まれません。
 国際疾病分類 10 の解釈は、診断、治療、および腫瘍学的病状の発症を予防する方法における規範的な文書です。 統計データにより、地域の罹患率を分析し、臨床治療プロトコルの実施を分析することが可能になります。
国際疾病分類 10 の解釈は、診断、治療、および腫瘍学的病状の発症を予防する方法における規範的な文書です。 統計データにより、地域の罹患率を分析し、臨床治療プロトコルの実施を分析することが可能になります。
RCHR (カザフスタン共和国保健省保健開発共和国センター)
バージョン: アーカイブ - カザフスタン共和国保健省の臨床プロトコル - 2007 (注文番号 764)
乳腺、特定されていない部分 (C50.9)
一般情報
簡単な説明
女性に最も一般的な腫瘍で、古典的なホルモン関連癌として分類されます。 体の生殖器系の一部である器官で発生します。 これらの腫瘍は、卵巣によって産生されるホルモン(エストロゲンとプロゲスチン)の「標的」である乳腺の管または小葉の上皮組織に由来します。
カザフスタン共和国では、平均して年間約 3,000 人の患者が乳がんと診断され、そのうち 1,380 人以上の女性が死亡しています。 特に、2005 年には 2,954 人の乳がん症例が登録され、人口 10 万人あたり 19.5 人 (アルマトイでは 32.3 人) に達しました。 1年死亡率は10.8%、5年生存率は49.3%です。
プロトコルコード: H-S-008 「乳房の悪性新生物。乳がん」
プロフィール: 外科用
ステージ:病院
ICD-10 コード:C50 乳房の悪性新生物
分類
乳房腫瘍の組織学的分類
現在、国際癌撲滅連合の組織学的分類 (2002 年、第 6 版) を使用するのが通例です。
| あ | 非浸潤がん(上皮内がん): |
| 管内(小管内)上皮内癌 | |
| 上皮内小葉がん | |
| で | 浸潤がん(浸潤がん): |
| 乳管 | |
| 小葉状 | |
| 粘液性(粘液性) | |
| 髄質 (髄質) | |
| 管状 | |
| アポクリン | |
|
他の形態(乳頭状、扁平上皮、若年性、紡錘体細胞、 仮性肉腫など) |
|
| と | 特殊な (解剖学的および臨床的) フォーム: |
| パジェットがん | |
| 炎症性がん |
最も多くの場合、患者は浸潤性乳管がん (50 ~ 70%) を経験し、次に小葉がん (20%) が続きます。 乳管がんは乳管に沿ってより頻繁に広がるのが特徴で、小葉がんは原発性多発性と両側性が特徴です。
国際分類 TNM
現在、国際対がん連合の TNM システム (2002) に従った腫瘍の分類が使用されています。 がんの病期は患者の最初の検査で確定され、手術後に明らかにされます (pTNM)。
この分類は癌腫にのみ適用され、男性の乳房と女性の乳房の両方に適用されます。
1つの乳腺に原発性多発同時腫瘍が存在する場合、最も高い腫瘍
カテゴリ T. 同時性両側乳房腫瘍は、組織型に応じて症例を分離できるように独立して分類する必要があります。
カテゴリ T、N、および M を評価するには、次の方法を使用する必要があります。
解剖学的領域:
1. ニップル (C 50.0)。
2. 中央部分 (C 50.1)。
3. 上部内側象限 (C 50.2)。
4. 内側の象限下部 (C 50.3)。
5. 上部外側象限 (C 50.4)。
6. 外側下部四分円 (C 50.5)。
7. 腋窩尾 (C 50.6)。
所属リンパ節:
1. 腋窩(同側)、胸間節(ロッテル)、腋窩静脈とその枝に沿ったリンパ節は、次のレベルに分類できます。
レベル I (腋窩の下部): 小胸筋の外側境界の外側に位置するリンパ節。
レベル II (腋窩の中央部分): 小胸筋の内側と外側の境界と胸郭間リンパ節 (ロッテル) の間に位置するリンパ節。
レベル III (腋窩窩の頂端部分): 頂端リンパ節および小胸筋の内側境界の内側に位置するリンパ節。ただし、鎖骨下と定義されたものは除く。
注記。 乳房内リンパ節は腋窩リンパ節としてコード化されます。
2. 鎖骨下 (同側) リンパ節。
3. 乳房内 (同側) リンパ節: 胸腔内筋膜の胸骨の端に沿った肋間領域のリンパ節。
4. 鎖骨上 (同側) リンパ節。
他のリンパ節への転移は、頸部または対側乳房内リンパ節を含む遠隔転移 (M1) として定義されます。
TNM 記号は以下を意味します: T - 原発腫瘍。
| 送信 | 原発腫瘍を評価するにはデータが不十分です。 |
| T0 | 乳腺内の腫瘍は検出されません。 |
| です |
前浸潤癌(上皮内癌) Tis (DCIS) - 上皮内乳管癌 Tis (LCIS) - 上皮内小葉癌 Тis (パジェット) - 腫瘍を伴わないパジェット病 (乳首) 注: 腫瘍の存在を伴うパジェット病は次のように分類されます。 腫瘍の大きさに応じて。 |
| T1 | 最大寸法が 2 cm 以下の腫瘍 |
| Т1マイク |
最大寸法0.1cmまでの微小侵入 注: 微小浸潤とは、がん細胞が領域を超えて広がることです。 0.1cm未満の病変を伴う基底膜の限界 微小浸潤の病巣が複数ある場合、最大のものは次に従って分類されます。病変のサイズ(微小病巣のサイズを要約することは不可能です) 可用性 微小浸潤の複数の病巣にもさらに注目する必要がある |
| T1a | 最大寸法が0.1cmを超え0.5cm以下の腫瘍 |
| Т1b | 最大寸法が0.5cmを超え1cm以下の腫瘍 |
| T1 | 最大寸法が1cmを超え2cm以下の腫瘍 |
| T2 | 最大寸法が2cmを超え5cm以下の腫瘍 |
| T3 | 最大径が5cmを超える腫瘍 |
| T4 |
胸壁に直接伸展するあらゆるサイズの腫瘍、または 肌 注: 胸壁には、肋骨、肋間筋、前胸筋が含まれます。鋸筋はありますが、胸筋はありません |
| T4a | 胸壁まで広がる |
| Т4b |
乳房の皮膚の腫れ(「レモンの皮」を含む)または潰瘍、または胸の皮膚の衛星 |
| Т4c | 4a と 4b に一緒にリストされている標識 |
| Т4d | 炎症性乳がん |
注: 炎症性乳癌は、丹毒の辺縁を伴うびまん性の褐色皮膚硬結を特徴とし、通常は下に腫瘤はありません。 皮膚生検で関与が示されず、限局性の検出可能な原発癌がない場合、カテゴリー T は炎症性癌の病理組織学的病期分類 (T4d) で pTx になります。
皮膚のくぼみ、乳頭の陥没、または T4b および T4d で見られるもの以外の皮膚の変化は、分類に影響を与えることなく、T1、T2、または T3 としてスコア付けされる場合があります。
N - 所属リンパ節。
| NX | 所属リンパ節の状態を評価するにはデータが不十分です |
| N0 | 所属リンパ節に転移性病変の兆候はない |
| N1 |
脇の腋窩リンパ節の転移 (e) 敗北 |
|
N2 N2a N2b |
固定された同側腋窩リンパ節への転移 または臨床的に明らかな同側乳房内リンパ節に存在する 腋窩リンパ節に臨床的に明らかな転移がない場合 腋窩リンパ節の相互または他の構造に関連した転移 臨床的に明らかな乳房内リンパ節のみに転移があり、 腋窩リンパ節に臨床的に明らかな転移がないこと |
| N3 |
同側鎖骨下リンパ節への転移腋窩リンパ節の損傷、または損傷がない。 または臨床的に明らかな 臨床的に存在する場合は同側乳房内リンパ節 腋窩リンパ節の明らかな転移。 または同側の転移腋窩リンパ節または乳房内リンパ節の関与を伴うまたは伴わない鎖骨上リンパ節 |
|
N3a N3b N3с |
鎖骨下リンパ節の転移 乳房内および腋窩リンパ節の転移 |
|
注記。 「臨床的に明白」とは、以下の結果として特定されたものを意味します。 臨床試験または画像処理( リンパシンチグラフィーを除く) |
M - 遠隔転移。
rTNM の病理組織学的分類。
pT - 原発腫瘍。
病理組織学的分類には、切除縁に肉眼的腫瘍がない場合の原発癌の検査が必要です。 辺縁に微視的な腫瘍のみがある場合、症例は pT として分類できます。
注記。 pT を分類する場合、腫瘍サイズは浸潤成分のサイズとなります。 大きな原位置成分 (例: 4 cm) と小さな侵襲成分 (例: 0.5 cm) がある場合、腫瘍は pT1a として分類されます。
рN - 所属リンパ節。
組織病理学的分類のために、1 つ以上のセンチネルリンパ節の検査が行われる場合があります。 分類が後続の腋窩リンパ節郭清を行わずにセンチネルリンパ節生検のみに基づいている場合は、(sn) (センチネルリンパ節) と指定する必要があります (例: pN1 (sn))。
| рN1分 | 微小転移(0.2 mmを超え、最大寸法が2 mm以下) |
| РN1 |
1~3 個の同側腋窩リンパ節の転移 (e) および/または 顕微鏡的転移を伴う同側乳房内リンパ節センチネルリンパ節郭清の結果として特定されるが、臨床的に明らかではない |
| £1а |
1~3個の腋窩リンパ節に転移(e)、そのうち少なくとも1個最大寸法が 2 mm 以上のもの |
|
рN1b рN1с |
顕微鏡的転移のある乳房内リンパ節、 センチネルリンパ節郭清の結果として特定されるが、臨床的には 明示的ではない 解剖の結果、1~3 個の腋窩リンパ節および乳房内リンパ節に転移があり、顕微鏡的転移が確認されたセンチネルリンパ節、しかし臨床的に明らかではない |
| рN2 |
4~9 個の同側腋窩リンパ節または 臨床的に明らかな同側乳房内リンパ節、 |
|
注記。 「臨床的にサイレント」とは、臨床検査または画像検査によって検出されないことを意味します(ただし、リンパシンチグラフィー); 「臨床的に明らかな」とは、臨床検査または画像処理(リンパシンチグラフィーを除く)または肉眼的に視覚的に確認されるものを意味する。 |
|
| рN2а |
4~9個の腋窩リンパ節に転移があり、少なくとも1個は2mmより大きいものを含む |
| рN2b |
臨床的に明らかな乳房内リンパ節への転移 腋窩リンパ節に転移がないこと |
| рN3 |
10個以上の同側腋窩リンパ節に転移がある。 またはで 同側鎖骨下リンパ節。 または臨床的に明らかな 同側乳房内リンパ節(存在する場合)または 腋窩リンパ節の影響がさらに大きい。 または、臨床的に明らかな顕微鏡検査がない3つ以上の腋窩リンパ節にある 乳房内リンパ節の転移。 または同側で 鎖骨上リンパ節 |
| £3а |
10個以上の腋窩リンパ節への転移(少なくとも1個) そのうち2mm以上)または鎖骨下リンパ節に転移がある |
| рN3b |
臨床的に明らかな乳房内リンパ節への転移がある場合影響を受けた腋窩リンパ節。 または3つ以上の転移がある 腋窩リンパ節および乳房内リンパ節では、 センチネル解剖中に顕微鏡的転移が特定された リンパ節、しかし臨床的には明らかではない |
| рN3с | 鎖骨上リンパ節への転移 |
rM - 遠隔転移。 PM カテゴリは M カテゴリに対応します。
G 病理組織学的分類
G1 - 高度な差別化。
G2 - 平均的な分化度。
G3 - 差別化の度合いが低い。
R分類
治療後の残存腫瘍の有無は、R という記号で表されます。R 分類の定義は次のとおりです。
RX - 残存腫瘍の存在を判断できません。
R0 - 残存腫瘍なし。
R1 - 顕微鏡的な残存腫瘍。
R2 - 肉眼で見える残存腫瘍。
段階ごとにグループ化する
| ステージ0 | TiS | N0 | M0 |
| ステージ I | T1* | N0 | M0 |
| ステージIIA | T0 | N1 | M0 |
| T1* | N1 | M0 | |
| T2 | N0 | M0 | |
| ステージ IIB | T2 | N1 | M0 |
| T3 | N0 | M0 | |
| ステージIIIA | T0 | N2 | M0 |
| T1* | N2 | M0 | |
| T2 | N2 | M0 | |
| T3 | N1、N2 | M0 | |
| ステージIIIB | T4 | N0、N1、N2 | M0 |
| ステージIIIC | 任意の T | N3 | M0 |
| ステージ IV | 任意の T | 任意のN | M1 |
注記。 ※T1にはT1mic(微小浸潤最大寸法0.1cm以下)が含まれます。
|
です T1マイク T1a T1b T1c T4a T4b T4d |
現場で £2cm £0.1cm > 0.1 ~ 0.5 cm > 0.5 ~ 1 cm > 1 ~ 2 cm > 2 ~ 5 cm > 5cm 胸壁・皮膚 胸壁 皮膚の腫れ/潰瘍、サテライト皮膚上の結節 T4a および T4b に特徴的な兆候 炎症性癌 |
| N1 |
可動式 腋窩 |
pN1mi pN1a pN1b pN1c |
微小転移、> 0.2 mm 〜 2 mm 1-3 腋窩リンパ節 微小転移を伴う乳房内リンパ節、 センチネルリンパ節生検で特定されましたが、 臨床的に検出不可能 1-3 腋窩リンパ節と乳房内 微小転移のあるリンパ節が検出される センチネルリンパ節生検、ただし臨床的には 検出不可能な |
| N2a |
修理済み 腋窩 |
pN2a | 4-9 腋窩リンパ節 |
| N2b |
乳房内- 臨床的に 定義済み |
pN2b |
腋窩リンパ節なしで決定 |
| N3a | 鎖骨下 | рN3a |
³ 10 腋窩リンパ節または鎖骨下 ノード |
| N3b |
乳房内- ナイと腋窩 新しい |
рN3b |
臨床的には乳房内リンパ節 腋窩リンパ節で識別される または> 3 つの腋窩リンパ節および乳房内 微小転移が検出されたノード センチネルノード(センチネルノード)の生検を伴う、 しかし臨床的には検出できない |
| N3c | 鎖骨上 | рN3c | 鎖骨上 |
危険因子とグループ
危険因子の分類
1. 体の生殖器系の機能を特徴付ける要因:
月経機能;
性機能;
出産機能。
授乳機能;
2. 卵巣および子宮の過形成性および炎症性疾患。
内分泌代謝因子併発疾患または以前の疾患が原因である場合:
1. 肥満。
2. 高血圧。
3. 糖尿病。
4.肝臓病。
5. アテローム性動脈硬化。
6. 甲状腺の病気。
7. 乳腺の不ホルモン過形成。
遺伝的要因(BRCA-1 または BRCA-2 遺伝子の保有者):
1. 血縁者の乳がん(遺伝性乳がんおよび「家族性」乳がん)。
2. 乳卵巣症候群(家族内に乳がんと卵巣がん)。
外因性要因:
1. 電離放射線。
2. 化学発がん物質(喫煙を含む)。
3. 動物性脂肪の過剰摂取、高カロリーの食事。
4. ウイルス。
5. ホルモン剤を服用する。
診断
診断基準
苦情(乳がんに特徴的な症状はありません)。
乳腺内の形成の存在、充血、腫れ、しわ、その上の引っ込みまたは突出、乳輪領域の狭窄などについての苦情がある場合があります。
既往歴:近親者のがんの存在、月経の開始、初産と初産の年齢、OC または HRT の服用、婦人科疾患。
身体検査
1. 乳腺の検査。
検査により、次のことを判断します。
乳腺の対称的な位置と形状。
乳首の位置とその外観のレベル(後退、横への偏り)。
皮膚の状態(充血、腫れ、しわ、皮膚の陥没や突出、乳輪領域の狭窄など)。
乳頭からの病的な分泌物(量、色、期間)。
患側の腕の腫れの存在。
2. 乳腺の触診(垂直位置および水平位置)。
3. 局部リンパ節および頸部鎖骨上リンパ節の触診(通常は垂直位置で行われます)。
実験室研究
治療前の患者の初診時に実施する必要がある臨床検査:全血球計算、血液型、Rh因子、一般的な尿検査、生化学的血液検査(尿素、ビリルビン、グルコース)、RW(ワッサーマン反応)、凝固図、ECG(心電図検査) )。
器楽の研究
X 線診断は、特に腫瘍が小さく触知できない場合に乳がんを検出するための主要な方法の 1 つです。 マンモグラフィーはすべての乳がん患者に適応されます。
治療を開始する前に患者が実施しなければならない検査方法:
1. 細胞学的検査を伴う腫瘍の穿刺生検、または ER、PR、Her-2/neu およびその他の遺伝因子の発現レベルの決定を伴うトレフィン生検。
2. 腹部臓器の超音波検査。
3. 肺のX線検査。
4. オステオシンチグラフィー(放射性同位元素検査室を備えた施設で)。
5. 乳腺、所属リンパ節の超音波検査。
マンモグラフィーと超音波検査は相互に補完し合うため、 マンモグラフィーでは、超音波では検出できない腫瘍が明らかになることもありますし、その逆も同様です。
形態学的診断:
1. 細胞学的(穿刺)生検(細針生検)。
2. トレフィン生検または乳腺の扇形切除。
専門家に相談するための指示。
必須:婦人科医との相談。
必要に応じて、適応症に応じて内分泌科医、神経内科医、泌尿器科医、放射線科医、化学療法医、およびその他の関連専門家に相談してください。
主な診断手段のリスト:
1. ヘモグロビンの測定。
2. ゴリャエフ室の白血球を数える。
3. CPK の赤血球を計数します。
4. ESRの決定。
5. ヘマトクリット。
6. 白血球式の計算。
7. 一般的な尿分析。
8. 総タンパク質の測定。
9. 組織の細胞学的検査および組織学的検査。
10. 毛細管血液凝固時間の測定。
11. 血小板数。
12. HIV の血液検査。
13. 微小反応。
14. HbsAg、抗 HCV。
15. タンパク質画分の測定。
16. ビリルビンの測定。
17. 凝固図 1 (プロトロンビン時間、フィブリノーゲン、トロンビン時間、aPTT、血漿線溶活性、ヘマトクリット。
18. 残留窒素の測定。
19. グルコースの測定。
20. ALTの定義。
21. ASTの定義。
22. チモール検査。
23. 血液型および Rh 因子の決定。
24. 腹部臓器の超音波検査。
25. 心電図検査。
26. 2 つの投影法による胸部 X 線。
27. 乳腺の超音波検査。
28. マンモグラフィー。
29. 乳管造影。
30. 骨盤臓器の超音波検査。
31. 乳房の磁気共鳴画像法 (MRI)。
32. 乳房のコンピューター断層撮影 (CT)。
追加の診断手段のリスト:
1. 心臓専門医に相談してください。
鑑別診断
| 苦情 |
物理的な データ |
超音波、 マンモグラフィー |
形態学的に電子サイン |
|
| RMJ |
教育の利用可能性 乳腺、 充血、浮腫、 凹凸、 その上に膨らみ、 |
検査の際、存在 触診時 乳房に腫瘍が存在する、 地域性の増加 リンパ節 |
可用性 での教育 乳製品 腺、 石灰化、 増加 地域的な リンパ節 |
細胞の存在 塗抹標本の腫瘍。 結論 病理学者について 可用性 悪性の 腫瘍 |
|
炎症性 乳房の病気 |
充血、 熱中症、 胸の痛み 腺、 化膿性分泌物 |
検査すると充血がある 触診時 痛みの存在 胸部にシールを貼り、 事後的に可能 時々拡大される リンパ節 |
空洞の存在 液体 コンテンツ 明確な境界線がないまま |
可用性 要素 化膿性の 炎症、炎症 白血球、 好中球 マクロファージ、 線維芽細胞 ストローク。 組織学的に - 膿瘍の写真、 化膿性浸潤 |
|
線維腺腫、 嚢胞腺腫 MJ、 ローカライズされた 線維腺腫トズ |
教育の利用可能性 乳腺、痛み |
検査すると可能です 乳房の変形。 シールの存在 MJ |
可用性 からの教育 クリア 輪郭付き マンモグラフィー - 「縁」の存在 安全" |
ペリの存在、 管内- 眼球と 混合された 線維腺腫 |
|
嚢胞 乳腺 |
ソフトエラスティックの利用可能性 乳腺、痛み、 乳頭分泌物 |
検査の上 変形の可能性 MJ。 触診時 教育の利用可能性 柔らかい弾性のある 胸の一貫性 |
可用性 液体が入った空洞 満足して 明確な輪郭 |
壁の存在 嚢胞、液体内容物 |
海外での治療
韓国、イスラエル、ドイツ、米国で治療を受ける
医療ツーリズムについてアドバイスを受ける
処理
治療戦略
治療目標:根本的な治療を実現します。
非薬物治療
乳がんは、すべての病期の治療が多岐にわたる数少ない腫瘍疾患の 1 つです。
乳がんの新しい治療法の開発は大きく進歩しているにもかかわらず、依然として手術がこの病気の主要な治療法であり、場合によっては唯一の治療法です(Ca in situ)。
どちらのタイプの根治手術を選択するかは、腫瘍の進行の広がりの程度だけでなく、臨床形態、腫瘍の位置、患者の年齢、および全身状態を特徴付けるその他の要因によっても決定されます。
近年、乳腺の臓器温存手術や局所組織を用いた再建手術による生活の質の向上が重要視されています。
乳がんの臓器温存手術は、高い生存率とともに、美容上も機能上も優れた結果をもたらします。 乳腺の部分切除後の患者の社会的および労働的リハビリテーションは、乳房切除術後よりも早く行われます。
乳腺に対する臓器温存手術の適応:
サイズ2.5cmまでの結節状癌の存在。
腫瘍増殖の多中心性および多巣性の欠如(マンモグラム、超音波、臨床上)。
成長速度が遅く中程度で、腫瘍サイズが 3 か月以内に 2 倍になる(病歴による)。
手術の良好な美容結果を得るために、乳房と腫瘍のサイズの好ましい比率。
遠隔転移はない。
腋窩領域に単一転移が存在することは許容されます。
乳がんのステージ I ~ III の再建手術は、患者の希望に応じて、どの腫瘍部位でも行うことができます。
女性はあらゆる種類の外科的介入に精通している必要があります。
放射線治療技術
乳房および局所転移領域(鎖骨上、腋窩)の放射線治療は、加速器(6 MeV)またはガンマ線治療装置(1.25 MeV)からの制動放射を用いて行われ、胸骨傍ゾーンの場合は光子線と電子線を交互に照射することによって行われます。または、胸骨傍リンパ節の連鎖の深さに応じて、最大 20 MeV の電子放射線のみを使用します。
60℃での胸骨傍ゾーンの照射、または4 MeVを超えるエネルギーの光子線のみの照射は、放射線照射後の肺炎、縦隔炎、および心膜炎の発症を伴います。 術前放射線療法は、術前化学療法や内分泌療法に抵抗性のある局所進行性乳がんを除いて、世界中の多くの科学センターで実施されていません。
乳房切除術後の前胸壁への術後照射、または根治的切除後の残りの乳腺への照射は、肺組織の 2 cm を超えない範囲が 100% に該当するように、接線領域から 1.25 MeV または 6 MeV の光子ビームを照射して行われます。等線量ゾーン。
接線方向のフィールド。 境界線:
1. 胸鎖関節の上部 (ルイ角)。 必要に応じて、乳房全体を含むように上部境界線をより高い位置に配置できます。
2. 内側 - 胸骨の中央に沿って。
3. 下 - 乳房下 (移行期) ひだの下 2 cm。
4. 側方 - 触知可能な乳房組織の側方 2 cm、通常は腋窩中央線に沿っています。
乳房切除術後の術後期間では、接線フィールドの境界は次のようになります。
1. ルイの上隅。
2. 内側 - 体の正中線。
3. 下部 - 反対側の腺の乳房下ひだのレベル。
4. 横方向 - 中央の腋窩線。
術後の瘢痕の位置が非典型的で、照射野の指定された境界の外側に位置する場合は、境界を少なくとも 2 cm 超えて組織をカバーするように瘢痕領域を追加照射することが推奨されます。 このような照射は、電子ビームまたは接触放射線療法を使用して実行する必要があります。
鎖骨上フィールド。
鎖骨上および腋窩リンパ節の照射は前方視野から行われ、食道および気管への照射を避けるためにビームは同じ名前のリンパ節の側に 10 ~ 150 度傾けられます。
フィールドの上端は、輪状甲状凹部の上端のレベルにあります。
内側境界は胸骨の中央です。
外側境界 - 上腕骨頭の内側端。 腋窩全体を照射する必要がある場合は、側縁を上腕骨頭の側端まで拡張し、保護ブロックで覆う必要があります。
下縁は、第 2 肋骨の胸骨への取り付けレベル (ルイ角) で接線領域の上縁と接触しています。
喉頭、食道、気管は常に鉛ブロックで保護されています。
後腋窩野は、腋窩ゾーン全体を照射する必要がある場合に使用されます。
フィールドの内側境界は胸の端から 1 cm 内側に位置します。
上縁は鎖骨の上端です。
側縁 - 上腕骨頭の側縁。
下縁は鎖骨上領域の下縁と同じレベルです。
胸骨傍野。 境界線:
内側端は胸骨の正中線です。
側縁は正中線の外側に4〜5cmあります。
上端は鎖骨上領域の下端です。
下端は胸骨の剣状突起の基部です。
いくつかの隣接するフィールドを照射する場合、これらのフィールドの境界間の距離は、選択した放射線エネルギーの種類に応じて決定する必要があります。
照射野の寸法は、超音波、コンピューター断層撮影、X 線シミュレーターを使用した照射前の準備中に個別に選択されます。
標準的な術後照射は、通常の線量分割モード (ROD 2 Gy、SOD 40 Gy) で乳腺、胸壁、および局所転移領域に対して行われます。 施設に電子線がある場合、部分切除を受ける患者では、術後の瘢痕領域(つまり腫瘍床)に 12 Gy の線量を追加照射できます。
乳がんの術後補助療法
乳がんのさまざまなサブタイプは、遺伝子プロファイルと選択された標的の免疫組織化学的証明に基づいて明確に認識されるようになりました (Sorlie, 2001; Regan, 2006)。 全体的な治療戦略では、可能な限り標的療法が最も重要であることが強調されていますが、「標的特異性の低い」追加の化学療法が必要な場合もあります。
標的の同定を含め、タイムリーで正確かつ信頼できる組織病理学的評価の絶対的な重要性が明らかになりました。 したがって、臨床医と病理学者の緊密な連携により、長期的な治療成績が大幅に向上します。
用語のさらなる明確化は、内分泌過敏症の定義にも関係しました。 2005 年に説明された 3 つの感度カテゴリは基本的に変更されていませんが、2007 年のガイダンスではより具体的にされました。
1. 腫瘍は内分泌療法に対して非常に敏感です (ほとんどの腫瘍細胞ではエストロゲン受容体 (ER) とプロゲステロン受容体 (PR) が高発現しています)。
2. 内分泌療法に対する感受性が不完全(不十分)である腫瘍(ER および/または PR の発現が低い)。
3. 内分泌療法に対して非感受性の腫瘍(ER と PR の両方が完全に存在しない)。
内分泌感受性の程度は定量的に変化し、内分泌療法のみで十分かどうかを判断する再発リスクの評価と相関しています。 内分泌感受性が高いことの絶対的な閾値を定義することはできませんが、リスクが低い患者(表 1)は内分泌療法のみに適していると考えられますが、内分泌感受性の高い腫瘍が存在する患者では追加の化学療法が必要になる可能性があります。再発の中程度または高リスク因子の患者、および腫瘍の内分泌感受性が不十分な患者。
リスクが高いとみなされるには、腫瘍周囲の血管浸潤が広範である必要があります(つまり、2 つ以上の腫瘍ブロックで腫瘍塞栓が観察される)。
一部の小さな腫瘍および組織学的サブタイプは、ステロイドホルモン受容体の発現が欠如しているにもかかわらず、リスクが低いと考えられる場合があります(髄様癌、アポクリン癌など)。
HER2 の発現または増幅のレベルは危険因子であると同時に、治療標的でもあります。
提案されたアルゴリズム (表 2) は、近い将来、最適な治療法を選択するのに役立つはずです。
3 つの機密性カテゴリが定義されています。
1. 内分泌療法に対して非常に感受性の高い腫瘍。 これらは、両方のステロイド ホルモン受容体の発現が高い腫瘍です (許容される免疫組織化学的方法によって決定されます)。
2. 内分泌療法に対する感受性が不十分(2005 年の分類では、不明瞭な内分泌感受性と指定されている)。 これらの腫瘍では、ステロイド ホルモン受容体の発現がある程度見られますが、レベルが低いか、受容体のいずれか 1 つ (ER または PR) の発現が欠如しています。
3. 内分泌療法に反応しない腫瘍。 ステロイドホルモン受容体の発現はありません。 このグループは内分泌抵抗性として明確に定義されていますが、さまざまな表現型の腫瘍が含まれています (Sorlie、2003)。
HER2陽性
HER2 陽性を判定するには 2 つの技術があります。
免疫組織化学的手法 - 30% 以上の腫瘍細胞の染色 (最大 3+)。
別の方法は、FISH 法 (蛍光 in situ ハイブリダイゼーション: 染色体 17 のセントロメアに対する HER2 遺伝子コピーの比率が 2.2 以上である) または CISH 法 (発色 in situ ハイブリダイゼーション) によって遺伝子増幅を測定することです (Wolff, 2007)。 。
明らかな免疫組織化学的染色 (HER2+++) の存在がトラスツズマブに対する感受性と関連していることは、多くの臨床試験ですでに明確に示されています。 理論的には、増幅が存在する場合でも、染色が弱い (1+ または 2+) と、トラスツズマブの活性が低いことに関連するはずです。 研究 9831 (Perez、2007) はこの仮説を評価していますが、特定の生物学的マーカーと抗 HER 療法との相関関係については、さらに大規模な試験が必要です。
2007 年に、パネルはリスク分類に若干の変更を加えました (表 1)。
腫瘍周囲の血管浸潤は、それが広範囲にわたる場合にのみリスクカテゴリーを増加させます (Colleoni、2007)。 ステロイドホルモン受容体の完全な欠如、および HER2 の増幅または発現増加は、通常これらの受容体を含まない髄様がんやアポクリンがんなどの稀な形態の腫瘍を除き、低リスクを除外するのに十分であると考えられます。
2005 年と同様、パネルは、いわゆる「Qncotype Dx™ 分子アプローチ」、「Mamma Print™ 遺伝子発現プロファイル」を、リスク カテゴリを決定するための十分に正確な検査として受け入れませんでした。 両方の方法は現在、前向き臨床研究でテストされています (Sparano、2006; Bogaerts、2006)。
治療法の選択に対する具体的なアプローチ
地域および地域の治療
サンガレン会議で発表された外科的治療は主に乳房温存手術、不必要な腋窩郭清を避けるためのセンチネルリンパ節の検出と除去技術に焦点を当てていた。 遠隔転移がある場合の乳房手術の理論的根拠も示された。 しかし、外科的治療のこれらの側面は、委員会によって特に取り上げられませんでした。
放射線治療に関するいくつかの問題が議論されました。 ASCO および EUSOMA ガイドラインは、術後放射線療法を計画するための実践ガイドラインとして使用できることが合意されています (Recht, 2001; Kurtz, 2002)。
現代の放射線治療の標準では、放射線治療(特に胸の左半分)を計画する際に CT スキャン シミュレーターの使用と、心臓への「最小限の放射線被ばく」技術の使用が含まれています(Korreman、2006)。
カテゴリーT1~T2の腫瘍を有する局所転移(pNO)のない乳がん患者に対する乳房切除術後の放射線療法の拒否については、専門家の間で完全な合意が得られた。 同時に、半数をわずかに上回る専門家が、4 つ以上のリンパ節に罹患している場合には放射線治療を実施することが賢明であると考えています。 2006年12月にサンアントニオで発表されたオックスフォードEBCTCGグループのデータは、乳房切除術後および1~3個のリンパ節を患う女性に対する放射線治療の適切性を示している。
リンパ節が関与している患者の場合は、胸壁および鎖骨上領域を照射量に含めることをお勧めします。 専門家らは腋窩領域への照射に同意した。 腋窩の完全な切除が行われる場合は避けるべきです。 ほとんどの専門家は放射線を避けることを好む
内分泌療法を計画している高齢患者に対する治療(臓器温存手術後であっても)。 放射線療法が必要な場合、高齢患者も放射線療法の基準に従わなければならないと考えている委員は少数である。
放射線療法の他の多くの「革新」は、専門家によって支持されていませんでした。それは、同時(併用)化学放射線療法、腫瘍床のみの「部分的」放射線療法、低分割による放射線療法期間の短縮です。 放射線療法が終了するまで内分泌療法を延期するという提案は支持されません。
全身補助療法プログラム
2005 年と同様に、主な決定は許容可能な標的療法を決定することでした。 内分泌療法に対する感受性が非常に高い腫瘍と感受性が不十分な腫瘍の場合、ホルモン治療の選択は患者の閉経状態によって異なります。 細胞傷害性化学療法を受けたばかりの患者にアロマターゼ阻害剤を処方するかどうかを決定するのは難しい場合があります。 専門家らは、アロマターゼ阻害剤の使用前および使用中に閉経後の状態を確認することを義務付けると主張している。
身体を特徴付ける他の要因や付随する病気も、治療法を選択する際に重要です。 たとえば、血栓塞栓症の病歴がある場合は、タモキシフェンを使用できません。 付随する心臓病状の存在は、特定の化学療法剤 (アントラサイクリン系) の選択やトラスツズマブによる治療の可能性に影響を与える可能性があります。 患者の年齢および付随する病状により、より強力な化学療法の使用が制限される場合があります。 予想される副作用の種類は、治療戦略ごとに患者の好みに影響を与える可能性があります。
閉経後の患者に対する内分泌療法
第 3 世代アロマターゼ阻害剤 (AI) の高い有効性が十分に証明されているため、タモキシフェンの使用が四半世紀にわたってかなり成功してきた後、適切な治療法の選択が大幅に容易になりました (Winer, 2005; Coates, 2007; Coombes, 2007; Goss, 2005; Howell、2005; Jakesz、2005)。 しかし、パネルメンバーの大多数は、一部の患者にとってはタモキシフェン単独の5年間のみが依然として信頼できる補助療法であると信じている。 AI を使用する戦略の中で、専門家委員会は「逐次」内分泌療法、つまり 2 ~ 3 年間のタモキシフェン療法後に AI に切り替えることを明確に支持しています。
パネルのかなりの少数派も IA の初期使用を支持しました。 そして、5年間のタモキシフェン投与とそれに続くAIという「前向きな」政策を支持するパネルメンバーはほとんどいなかった。 すでに5年間のタモキシフェン治療を完了した患者について、パネルはその後のAIの追加使用を支持しているが、これは局所転移のある患者に限る。 AI の初期(前もって)の使用は、再発リスクが高い患者または HER 2 陽性乳がんの患者においてより適切です。 SSRI 抗うつ薬を受けている患者に AI を最初に使用することも推奨されます。
パネルは明らかに、細胞傷害性化学療法と内分泌療法の同時投与ではなく、逐次投与を好んだ。 最適な補助内分泌療法の総期間は 5 年から 10 年の範囲になります。
ほとんどの専門家は、閉経後の若い女性の卵巣抑制のスクリーニングが必要であると考えているが、そのような検査のタイミングや年齢は依然として不明である。
同委員会は、AIの処方やカルシウムとビタミンDの使用前に骨密度を評価し、特に骨量減少やAI使用に伴う症状のリスクを軽減するために運動する必要性を支持している。
閉経前患者における内分泌療法
専門家委員会は、閉経前乳がん患者に対する術後内分泌療法の標準として全会一致で承認した。
- 卵巣機能の抑制と組み合わせたタモキシフェンの投与、または
- タモキシフェン単独による治療。
患者が将来の妊娠を計画している場合、卵巣機能の抑制は可能であると考えられますが、タモキシフェンとの同時治療の拒否は完全には正当化できません。
この委員会は、卵巣機能を抑制する手段としてゴナドトロピン放出ホルモン (GHR) 類似体の使用を支持しています。 大多数の専門家は、外科的卵巣摘出術が受け入れられる方法であると考えています。 卵巣の「スイッチを切る」方法は、病気の種類やその他の状況によって異なります。 ほとんどの専門家は、卵巣を抑制するために卵巣に放射線を照射することを拒否した。 患者によっては、単一の GnH 類似体では卵巣機能を完全に抑制できない可能性があることに注意することが重要です (Jimenz-Gordo、2006)。
GnRH 類似体による卵巣機能抑制の最適な期間は依然として不明であるが、ほとんどの専門家は、特に再発リスクの高い ER+ 乳がん患者および/または HER2 (+) 疾患患者では、このような治療は 5 年間継続すべきであると考えている (モーリアック) 、2007)。
繰り返しになりますが、十分な証拠がないため、ほとんどの専門家は、化学療法が完了するまで GnRH 類似体の使用を延期することを提案しています。
閉経前乳がん患者に対する唯一の内分泌療法としてアロマターゼ阻害剤(AI)を使用することは容認できないと考えられています。
卵巣機能抑制の設定における AI の使用は、現在臨床試験でテストされています。
そして臨床試験以外では、タモキシフェンの使用に禁忌がある場合、そのような組み合わせ(AI + GnRH 類似体)が許可されます。 診断時に閉経前であったが、化学療法後または補助内分泌療法中に閉経後になった患者もAIを受けることができますが、AIの投与前および投与中に卵巣機能の停止を明確にする必要があります。そのような治療は通常、内分泌卵巣機能を刺激するためです。
(バローゾ、2006)。
化学療法
おそらく、最新の術後補助療法を計画する際に最も難しい問題は、内分泌療法に加えて追加の化学療法を処方すべき、内分泌感受性が高度または不十分な腫瘍を有する患者の選択である。 内分泌療法単独の妥当性が疑わしいことを示唆する兆候としては、ステロイドホルモン受容体の発現が比較的低いこと、所属リンパ節の転移性関与、高悪性度または高レベルの「増殖」マーカー、大きな腫瘍サイズ、広範な腫瘍周囲血管浸潤などが挙げられます。 治療選択を容易にするために提案された分子遺伝学的技術(Oncotype DXTM、Mamma printTM)は、治療アプローチの計画への貢献を示す説得力のある証拠が不足しているため、専門家によって支持されていません。
幅広い化学療法レジメンが許容されると考えられていますが、特定の「お気に入り」についてはほとんど合意がありません。 ほとんどの専門家は、HER 陽性腫瘍を含むすべての患者に対するアントラサイクリンの使用を支持しています。
専門家委員会は、トリプルネガティブ腫瘍 (ER-、PR-、HER2-) の患者に DNA 損傷薬を含めることが適切であると考えています (James、2007)。 シクロホスファミド、5-フルオロウラシル、およびアントラサイクリンの組み合わせ(CAF、CEF、FEC、FAC)は、アントラサイクリンとシクロホスファミドの後にパクリタキセルまたはドセタキセルが続く組み合わせと同様に、パネルから幅広い支持を得ています。 高用量化学療法を支持するパネルメンバーはほとんどおらず、末梢血幹細胞の維持を必要とする高用量化学療法を強く拒否した。
一般に、委員会は、内分泌感受性の高い腫瘍を有するが再発リスクが高い患者、または内分泌機能が不十分な患者に対して、「低強度」化学療法(ACレジメンの4コースまたはCMFレジメンの6コース)の使用を許可している。感受性の高い腫瘍および HER 2 陰性疾患。 CAFレジメンやドセタキセルとACの併用(TACレジメン)など、他のレジメンもこのグループの患者に適していると考えられています。
パネルメンバーのほとんどは、高齢患者にはより短い期間の化学療法(12~16週間)が適切であると考えており、そのような治療の早期開始は受容体陰性腫瘍(ER-/PR-)患者にとって特に重要である。 ただし、十分な余命がある高齢患者には標準的な化学療法を提供する必要があります。 パネルメンバーは発熱性好中球減少症患者における造血因子の価値を高く評価していますが、それらの日常的な使用を支持する人はほとんどいません。 造血因子による治療を受けた高齢患者では、急性白血病のリスクが増加することが報告されています (Hershman、2007)。
ただし、この情報はランダム化試験から得られたものではなく、前向き研究ではそのような合併症は指摘されませんでした。
表 3 は、上で説明した治療アプローチと概念をまとめたものです。
2007 年、腫瘍学者はステロイド ホルモン受容体 (ER/PR) と HER 2 という 2 つの標的療法を標的療法に定めました。治療計画においては、疾患再発のリスクは二次的な役割を果たしますが、リスクの大きさは考慮されるべきです。追加の化学療法の適応を決定する際(内分泌療法前)、内分泌感受性腫瘍を有する患者。
内分泌療法に対して非常に感受性の高い腫瘍を有する患者、特に他の予後不良の特徴がない場合(再発リスクが低および中程度、HER2-)、内分泌療法のみで問題なく受けられる可能性がありますが、再発リスクが高い患者では追加の化学療法が必要になる場合があります。 。
追加の化学療法に関する決定は、腫瘍の内分泌感受性の程度、危険因子、患者の好みの評価に基づいて行われるべきです。 専門家らは、治療決定を正当化する際に絶対的なルールはなく、患者と主治医の間で引き続き議論されることを強調している。
術前全身療法
臨床的には、局所進行性乳がん患者にとって、難しい治療法選択に遭遇することがよくあります。 このような腫瘍の割合は 5% ~ 40% の範囲です。 MIBC に対する術前補助全身療法を処方する理論的根拠は次のとおりです。
1. 潜在的な(微小転移性)広がりの可能性が高い。
2. 「きれいな」外科断端内での外科的介入の量を減らすことができる。
3. 治療に対する臨床反応を in vivo で評価する能力。
4. 腫瘍退縮の程度の正確な病態形態学的評価の利用可能性。
5. 一次全身治療の完了前、完了中、完了後に生検腫瘍物質の特別な研究が可能。
このタイプの全身治療の目標は次のとおりです。
1. 腫瘍の退縮を達成し、根治的な局所治療を実施します。
2. このグループの患者の予後は非常に好ましくないことを考慮し、長期的な治療成績を向上させるために全身療法を使用します。
術前補助全身治療のスキーム:
マンモグラフィー、超音波検査、ER、PR、Her 2/neu のレベルを測定するトレフィン生検。 術前化学療法 4 コース - 手術 - 補助化学療法 4 コース。 術前化学療法を 4 コース行っても効果が見られない場合は、化学療法レジメンを変更する必要があります。
大きな腫瘍に対するこのような治療法がすでに日常的に行われていることに基づいて、パネルメンバーの大多数は、乳がんの乳房温存治療を含む外科的治療を改善するための術前全身療法(ER+腫瘍に対する化学療法および/または内分泌療法を含む)の使用を支持した。 (Kaufmann、2006; Semiglazov、2007)術前補助療法に対する反応の大きさの評価は、(一部のパネルメンバーの意見では)補助療法で同じ治療を処方するための基礎として役立つ可能性があります。 パネルメンバーの大多数は、HER 2 陽性乳がん患者の術前治療プログラムにトラスツズマブを含めることも支持した。
表1。 手術可能な形態の乳がん患者におけるリスクカテゴリーの決定。 サンガレン、2007年。
| リスクカテゴリー | |
| リスクが低い |
影響を受けたリンパ節がないこと (p NO) および以下のすべての標識: p T ≤2 cm および悪性度 (G 1) および ERとPRの表現と HER 2/neu の発現または増幅の増加なし 年齢≧35歳 |
| 中程度のリスク |
影響を受けたリンパ節(p NO)が存在せず、少なくとも 次の少なくとも 1 つ: p T> 2 cm または 広範な腫瘍周囲血管浸潤の存在または HER 2/neu の発現または増幅の増加 年< 35 лет |
|
単一の局所転移の存在 (1-3) 関与する l/u) ER+ /PR+ の発現、 HER2/neu の発現または増幅の増加なし |
|
| リスクが高い |
単一の局所転移の存在(1~3はリンパ節に関与しており、ステロイドホルモン受容体(ER-PR-)の発現が欠如している)または |
| 4つ以上の罹患リンパ節の存在 |
表 2. 乳がんの術後補助療法の計画。サンガレン、2007年。
|
高感度 内分泌療法へ |
足りない 内分泌 センシティブ |
に鈍感 内分泌療法 |
|
| 彼女 (-) |
内分泌療法、 さらに 化学療法 ハイリスクグループ 再発 |
内分泌療法、 さらに 化学療法 中間と 再発のリスクが高い |
化学療法 |
| 彼女 (+++) |
内分泌療法 + トラスツズマブ+* 化学療法** |
内分泌療法 + トラスツズマブ + 化学療法 |
トラスツズマブ + 化学療法 |
*トラスツズマブ (ハーセプチン®) は、腫瘍が 1 cm 未満で転移性リンパ節 (pNO) がない女性、特に内分泌感受性の高い腫瘍を持つ女性の標準治療とは見なされません。
**入手可能な臨床試験データは、事前または併用化学療法なしでのトラスツズマブの推奨を裏付けるものではありません。
表 3. 治療標的とリスクカテゴリーに応じた補助療法。 サンガレン、2007年。
| 彼女2 (-) | 彼女 2 (+++) | |||||||||||
|
高い 内分泌 感じます。 |
不完全な 感情。 に 内分泌 |
鈍感 に 内分泌 治療 |
高い 内分泌 感じる |
不完全な 感情。 に 内分泌 |
鈍感 に 内分泌 治療 |
|||||||
| リスクが低い | ああ | ああ | ああ | ああ | ||||||||
|
プロメ- 気味の悪い ニューヨークのリスク |
×→ |
×→ |
×→ ああ |
×→ ああ |
バツ | バツ |
×→ e+t |
×→ e+t |
×→ e+t |
×→ e+t |
x+t | x+t |
|
×→ |
×→ |
×→ |
×→ EE |
×→ EE |
バツ |
×→ e+t |
×→ e+t |
×→ e+t |
×→ e+t |
x+t | x+t | |
| リスクが高い |
へー |
へー |
へー |
へー |
x+t | x+t | ||||||
|
×→え |
×→え | ×→え | ×→え | バツ | バツ |
×→ e+t |
×→ e+t |
×→ e+t |
×→ e+t |
x+t x+t |
x+t x+t |
|
X化学療法
E- 内分泌療法
T-トラスツズマブ (ハーセプチン)
内分泌療法に対する感受性に応じた乳がん患者の補助療法
AI - アロマターゼ阻害剤
CT - 化学療法
そこ - タモキシフェン
SOF - 卵巣機能の抑制(手術、放射線療法、
保守的)
AC - アントラサイクリン + シクロホスファミド
CEF、FEC - シクロホスファミド + エピルビシン + 5-フルオロウラシル
CAF - アントラサイクリン + シクロホスファミド + 5-フルオロウラシル
Tah - タキサン
しましょう - レトラゾール
EXE - エキセメスタン
アナ - アナストラゾール
BC のさまざまな段階の治療
0、ステージI
1. 臓器温存治療。
臓器温存手術後は、ER、PR、Her-2/neu の発現レベルを考慮して、全身治療の種類の 1 つが処方されます。 全身治療の必要がない場合は、放射線療法が処方される場合があります。 乳腺への照射は、線形加速器からの光子放射線 (6 MeV) または 60Co 装置からのガンマ放射線 (1.25 MeV) を使用して、接線方向に位置する 2 つのフィールドから行われ、乳腺への最も均一な照射を確保することを目的としています。 ROD 2 グレイ、SOD 60 グレイ。 術後の領域はさらに 12 Gy (各 2 Gy) の線量で照射されます。 電子トリガー照射が好ましい。
2. 根治的乳房切除術。
上記のステージ I の局在のすべてについて、腺の形状の修復を伴う根治的乳房切除術、または修復を行わない (患者の希望に応じて) 乳房切除術を行うことが可能です。
全身治療には、浸潤性腫瘍を有する50歳未満の患者に対する化学療法、受容体陽性腫瘍を有する閉経後の患者に対するタモキシフェンによる5年間のホルモン療法が含まれます。 月経機能が維持されている50歳未満の患者:タモキシフェンを服用しながら、両側卵巣摘出術またはLHRH類似体を2年間毎月投与。
ER、PR-PCT (CMF または CAF) が陰性の患者はホルモン療法を受けません。
ステージ 0 および I の化学療法レジメン:
CMFボナドンナ療法
メトトレキサート 40 mg/m*2 IV 1 日。
5FU 600 mg/m*2 IV 1 日。
3週間ごとに6サイクル繰り返します
シクロホスファミド 100 mg/m*2 を 1~14 日間経口投与。
5FU 600 mg/m*2 IV 1 日間および 8 日間。
プレドニゾロン 40 mg/m*2 を 1 日間および 14 日間経口投与。
4週間ごとに6サイクル繰り返します。
ドキソルビシン 60 mg/m*2 IV 1 日。
シクロホスファミド 600 mg/m*2 IV 1 日。
ステージ II
ただし、N0 の患者では、治療はステージ I の場合と同じですが、術後期間に予後不良の兆候 (年齢 35 歳未満、ホルモン受容体陰性、Her 2-neu 状態陽性) が存在する場合は、全期間を除きます。乳房では、腫瘍が内部象限または中央領域に局在している場合、および N+ のすべての患者(腋窩リンパ節の転移病変が 3 個以下)の場合、主要病変の側から胸骨傍および鎖骨上領域が追加で照射されます。 。
術後RTは、臓器温存手術と全身療法を行った後、古典的な線量分割モード(ROD 2 Gy、SOD 30 Gy)で実施されます。 術後の領域はさらに 12 Gy (各 2 Gy) の線量で照射されます。
N+患者では、4つ以上の腋窩リンパ節が罹患している場合、および/または腫瘍がリンパ節の被膜に浸潤している場合、残りの乳腺に加えて、罹患側の胸骨傍鎖骨上腋窩ゾーンが照射されます。
ステージ II のすべての患者は、補助全身化学療法 (CMF、AC、TAC、AC+T、FAC、CAF、FEC、A+ CMF) を受ける必要があります。
+ERタモキシフェンを5年間服用。
-ER - 化学療法の場合。
Her 2-neu 陽性患者の場合 - トラスツズマブ 1 日 8 mg/kg、21 日ごと 4 mg/kg
化学療法レジメン:
シクロホスファミド 100 mg/m*2 を 1~14 日間経口投与。
5FU 600 mg/m*2 IV 1 日間および 8 日間。
28日ごとに繰り返します。
メトトレキサート 40 mg/m*2 IV 1 日間および 8 日間。
5FU 600 mg/m*2 IV 1 日間および 8 日間。
28日ごとに繰り返します。
21~28日ごとに繰り返します。
5FU 500 mg/m*2 IV 1 日間および 8 日間。
ドキソルビシン 50 mg/m*2 IV 持続注入 72 時間 1 ~ 3 日間。
シクロホスファミド 500 mg/m*2 IV 1 日。
血液学的パラメーターが回復した場合は、21 を繰り返します。
タキソテール 75 mg/m*2 IV 1 日。
ドキソルビシン 50 mg/m*2 IV 1 日。
シクロホスファミド 500 mg/m*2 IV 1 日。
21日ごとに繰り返します。
シクロホスファミド 600 mg/m*2 IV 1 日。
5FU 600 mg/m*2 IV 1 日。
21 ~ 28 日ごとに繰り返します。
ドキソルビシン 60 mg/m*2 IV 1 日。
シクロホスファミド 600 mg/m*2 IV 1 日。
血液学的パラメーターの回復に応じて、3 ~ 4 週間ごとに繰り返します。
ドキソルビシン 60 mg/m*2 IV 1 日。
シクロホスファミド 600 mg/m*2 IV 1 日。 × 4 サイクル。
パクリタキセル 175 mg/m*2 の 3 時間点滴を 3 週間に 1 回、4 サイクル継続します。
ドキソルビシン 60 mg/m*2 IV 1 日。
シクロホスファミド 600mg/m*2 IV 1日×4サイクル。
ドセタキセル 75 mg/m*2 を 3 週間に 1 回、4 サイクル継続します。
シクロホスファミド 75 mg/m*2 を 1~14 日間経口投与。
エピルビシン 60 mg/m*2 IV 1 日。
5FU 500 mg/m*2 IV 1 日間および 8 日間。 毎月6サイクル。
ドキソルビシン 75 mg/m*2 IV 3 週間ごとに 1 日、4 サイクル。
シクロホスファミド 600 mg/m*2 IV 1 日。
メトトレキサート 40 mg/m*2 を 1 日間および 8 日間静注。
5FU 600 mg/m*2 IV 1 日間および 8 日間。
3週間ごとに8サイクルを繰り返します。
ステージ IIA では、一般的な効果が表に従って規定されます。 4.
表4. 腋窩リンパ節に転移がないこと
|
月経 状態 |
リスクが低い |
中程度および高リスク |
|
ホルモン感受性腫瘍 |
||
|
月経中 |
タモキシフェン ゾラデックスまたは ディフェレリン |
化学療法 化学療法 + タモキシフェン(場合) 卵巣機能をオフにする) |
|
閉経後 |
タモキシフェン IA |
タモキシフェン または化学療法 + タモキシフェンまたは AI |
|
ホルモン抵抗性腫瘍 |
||
|
月経中 |
化学療法 |
|
|
閉経後 |
化学療法 |
|
Her 2-neu 陽性患者 - トラスツズマブを 1 日に 8 mg/kg、21 日ごとに 4 mg/kg を 1 年間投与。 ER (-) および PR (-) 状態の生殖年齢に PCT (タキサンまたは SMF、アントラサイクリン系を除く) を併用した患者。 IAと組み合わせてER(+)およびPR(+)状態を有する閉経後患者、ER(-)およびPR(-)状態を有する閉経後患者では、PCT(アントラサイクリン系を除くタキサンまたはSMF)と組み合わせて治療を実施する必要がある。
6コースの化学療法終了後に8個以上の転移リンパ節があり、月経機能が継続している閉経前女性の場合、両側卵巣摘出術、またはLHH放出ホルモンアゴニスト(ジセレリン - 28日ごとに腹壁に3.6mgを皮下注射)の処方による卵巣機能のスイッチをオフにする必要があります。タモキシフェン 1 日あたり 20 mg を 5 年間服用中。 PCT 6 コース後に月経機能が停止した場合、1 日あたり 20 mg のタモキシフェンが 5 年間処方されます。

Her 2-neu 陽性患者 - トラスツズマブを 1 日 8 mg/kg、21 日ごとに 4 mg/kg を 1 年間投与。 ER (-) および PR (-) 状態の生殖年齢に PCT (タキサンまたは SMF、アントラサイクリン系を除く) を併用した患者。 IAと組み合わせてER(+)およびPR(+)状態を有する閉経後患者、ER(-)およびPR(-)状態を有する閉経後患者では、PCT(アントラサイクリン系を除くタキサンまたはSMF)と組み合わせて治療を実施する必要がある。
マデンによるRMEの範囲での治療終了から3週間後の手術、乳腺の根治的切除、臓器温存または再建形成手術。
外科的治療。 外科的処置は、根治的乳房切除術の範囲で一般に受け入れられている方法に従って実行されます(Madden、Patey による)。 外科的介入の範囲 (乳房切除術のオプション) は、腫瘍の進行の範囲によって決まります。 すべての場合において、腋窩、鎖骨下、肩甲下とその後のマーキングの3つのレベルの所属リンパ節の切除が必要となります。 腫瘍は、乳腺の四分円のサイズと位置に応じてマークする必要があります。
即時または遅延再建手術(患者の希望に応じて)を行うことが可能です。
術後放射線療法。 術後 RT は古典的な線量分割モード (ROD 2 Gy、SOD は等価線量 60 Gy まで) で実行されます。 照射野:鎖骨上、腋窩、胸骨傍、胸壁(рТ3、4)。 61. 赤血球細胞学的または組織学的診断検証、一般血液検査(6 指標)、一般尿検査、化学検査用血液(9 指標)、凝固検査用血液、心電図検査、肺の透視検査または R グラフィー、超音波乳腺、局所ゾーン、肝臓、骨盤臓器、マンモグラフィー。 乳管造影、磁気共鳴画像法、乳腺のコンピューター断層撮影、ホルモンレベルの測定(ER -、ER +、Her-2-neu)、アポトーシス、可能であれば適応症に従ってCA15-3。
情報
情報源と文献
- カザフスタン共和国保健省の疾病の診断および治療手順 (2007 年 12 月 28 日命令第 764 号)
- 1.V.F. セミグラゾフ、V.V. セミグラゾフ、K.Sh。 ヌルガジエフ。 乳がんの治療基準の正当化、362 ページ、アルマトイ、2007 年。 1. バローゾ G、メンカル G。 フェリックス・H・ロイアス=ルイス・J.C. 他。 制御された卵巣過剰刺激における組換え卵胞刺激ホルモンに対するアジュバントとしてのアロマターゼ阻害剤レトロゾールとクエン酸クロミフェンの有効性の比較:前向きランダム化盲検臨床試験。 //Fertil Steril .- 2006.- Vol 86p.1428-1431 2. Bogaerts J、Cardoso F、Buyse M、他。 予後ツールとしての遺伝子サイン評価: MINDACT 試験の設計における課題。//Nat Clin Pract Oncol .-2006.- Vol .3: p.540-551 3. Clarke CA、Glaser SL。 ホルモン療法の利用と乳がんの発生率の最近の減少:臨床的および集団ベースの証拠。 // J Clin Oncol.-2006.-Vol.24.p 49 4. Coates AS、Keshaviah A、fthurlimann B、他。 内分泌反応性早期乳がんの閉経後女性に対する初期補助療法としての 5 年間のレトロゾールとタモキシフェンの比較:研究 BIG 1-98 の最新情報 // J Clin Oncol.-2007 -Vol. 25 p.486-492 5. Colleoni M、Rotrnensz N、Peruzzotti G、他。 手術不能乳癌の腫瘍周囲血管浸潤の程度の予後の役割。 Ann Oncol .-2007 (出版受理) 6. Coombes RC、Kilburn LS、Snowdon CF、他。 「2~3 年後のエキセメスタンとタモキシフェンの生存および安全性」タモキシフェン治療 (グループ間エキセメスタン研究): ランダム化対照試験。 // Lancet.- 2007.- Vol.349.p.1110-1117 7. Goldhirsch A、Glick JH 、Gelber RD et al. 会議のハイライト: 早期乳がんの一次治療に関する国際専門家のコンセンサス.//Ann Oncol.-2005.-Vol.16.p.1569-1583 8. Goldhirsch A; Cda^es AS、Gelber RD et al. まずターゲットを選択します: 乳がん患者のためのアジュバント治療のより良い選択. // Ann Oncol.-2006.-Vol. 17 p.1772-1776 9. Goss PE、Ingle JNJ Martino S、他。受容体陽性乳癌における延長補助療法としてのタモキシフェン後のレトロゾールのランダム化試験: NCIC CTG MA.17 の最新の発見 // JNCI Cancer Spectrum.-2005.- Vol.97.p.1262-1271 10. Howell A, Cuzick J、Baum M、他、乳がんに対する 5 年間の補助療法完了後の ATAC (アリミデックス、タモキシフェン、単独または併用) 試験の結果。 // Lancet.-2005.-Vol 365.p.60-62 11. Jakesz R、Jonat W、Gnant M、他。 内分泌反応性早期乳がんを患う閉経後女性の2年後のアジュバントタモキシフェン投与後のアナストロゾールへの切り替え:ABCSG試験8とARNO 95試験の総合結果。 // Lancet.-2005.-Vol 366.p.455-462 12. James CR、Ouinn JE、Mullan PB 他。 BRCA1、乳がん治療における潜在的な予測バイオマーカー //腫瘍学者.-2007.-Vol. 2.p. 142-150 13. ヒメネス=ゴルド AM。 De Las Heras B. Zamora P. et al.: 閉経前乳がん女性におけるゴセレリン卵巣* 切除の失敗: 2 件の症例報告。 //Gynecol Oncol .- 2000. - Vol 76 p.126-127 14. Joensuu H、Kellokumpu-Lehtinen PL、Bono P、他。 乳がんに対するトラスツズマブの併用または非併用によるドセタキセルまたはビノレルビンのアジュバント。 // N Engl J Med .- 2006.- Vol 354. p.809-820 15. Kaufmann M、Hortobigyi GN、Goldhirsch A、: 他。 手術可能な乳がんに対する術前補助(一次)全身治療の使用に関する国際専門家委員会からの推奨事項: 最新情報 // J Clin Oncol.- 2006.-Vol 24p.1940-1949 16. Korreman SS。 ペデフセン AN. Aarup LR et al. 乳がんに対する呼吸適応ラジオテヘラプブ後の心臓および肺合併症の確率の減少. Int J Radiot //Oncol Biol Phvs.-2006.- Vol 65.p.1375-1380 17. Kurtz J. EUSOMA Working Party。手術可能な乳がんの治療における放射線療法の治癒的役割 //Eur J Cancer.-2002.- Vol 38.p.1961-1974 18. Mauriac L、Keshaviah A. Debled M Mouridsen H et al. 早期再発の決定要因BIG 1-98 試験におけるホルモン受容体陽性乳がんの閉経後女性における研究//Ann Oncol.- 2007.- Vol. 14 p.320-327 19. Perez EA. アジュバント化学療法と生物学的療法の併用. St. Gallen. .- //Breast.-2007 .- Vol.16 (Suppl): p105-111 20. Piccart-Gebhart MJ、Procter M、Leyland-Jones B et al. HER2 陽性乳がんにおける補助化学療法後のトラスツズマブ。 // N Engl J Medi -2005.-Vol.353p.1659-1672、21. Recht A. Edge SB. Splin LJ. Robinson PSet al. 乳房切除術後の放射線療法: 「米国臨床腫瘍学会の臨床診療ガイドライン//. J Clin Oncology. - 2001 - Vol 19.p.1539-69 22. Regan MM、Viale G、Mastropasqua MG、他。 乳がん補助療法の再評価: 免疫組織化学的アッセイと抽出アッセイによるホルモン受容体の状態の評価。 //JNCI がんスペクトル-2006-Vol. 98 p.1571-1581 23. Romond EH、Perez EA、Bryant J 他。 手術可能なHER2陽性乳がんに対するトラスツズマブと補助化学療法。 // N Engl J Med.-2005.-Vol. 353 p.1673-1684 24. セミグラゾフ V.F.、セミグラゾフ V.V. ダシアン G.A. 他 エストロゲン受容体陽性乳がん//がんの閉経後患者を対象とした、一次内分泌療法と化学療法の第2相ランダム化試験。 -2007-Vol 110.-p. 244-254 25. Slamon D、BCIRG 006 II 中間分析。 サンアントニオ乳がんシンポジウム、2006 年。 http://www.bcirg.org/Internet/BCIRG+at+SABCS+2006/default.htm 26. Sorlie T、Tibshirani R、Parker J、他。 独立した遺伝子発現データセットにおける乳房腫瘍のサブタイプの繰り返し観察。 // Proc Natl Acad Sci USA .- 2003.- Vol.100p.8418-8423 27. Sorlie T.、Perou CM、Tibshirani R 他。 乳癌の遺伝子発現パターンは、臨床的意味を持つ腫瘍のサブクラスを区別します。 // Proc Natl Acad Sci USA .-2001.- Vol. 98ページ 10869-10874 28. スパラノJA。 TAILOR: 個別の治療オプションを割り当てる試験。 // Clin Breast Cancer. - 2006. - Vol. 7: p347-350 29. Winer EP、Hudis C、Burstein HJ、他。 ホルモン受容体陽性乳がんを患う閉経後女性に対する補助療法としてのアロマターゼ阻害剤の使用に関する米国臨床腫瘍学会の技術評価: 現状報告書 2004. //J Clin Oncol.- 2005.- Vol 23: p.619-629。 30. Wolff AC、Hammond ME、Schwartz JN、他。 米国臨床腫瘍学会/米国病理学者協会、乳がんにおけるヒト上皮成長因子受容体 2 検査に関するガイドライン推奨事項 // Arch Pathol Lab Med.-2007.- Vol.131p.18。
情報
ムカンベトフ S.M.、腫瘍学研究センター
添付ファイル
注意!
- 自己治療を行うと、健康に取り返しのつかない害を及ぼす可能性があります。
- MedElement の Web サイトおよびモバイル アプリケーション「MedElement」、「Lekar Pro」、「Dariger Pro」、「Diseases: Therapist's Guide」に掲載されている情報は、医師との対面診療に代わることはできませんし、代用すべきではありません。 気になる病気や症状がある場合は必ず医療機関にご相談ください。
- 薬の選択とその投与量については、専門家と話し合う必要があります。 患者の病気や体の状態を考慮して、適切な薬とその投与量を処方できるのは医師だけです。
- MedElement の Web サイトおよびモバイル アプリケーション「MedElement」、「Lekar Pro」、「Dariger Pro」、「Diseases: Therapist's Directory」は、もっぱら情報および参照リソースです。 このサイトに掲載されている情報を医師の指示を許可なく変更するために使用してはなりません。
- MedElement の編集者は、このサイトの使用によって生じた人身傷害や物的損害に対して責任を負いません。
ホルモン感受性の乳癌の患者には、複雑な治療が必要です。 特定のレジメンの選択は、がん患者の年齢、病気の段階、転移の特徴によって決まり、次のような治療法が含まれる場合があります。
影響を受けた組織を外科的に除去します。プロセスの有病率とそのプロセスへのリンパ節の関与を考慮して、乳腺の切除が行われます。 体積の観点から、そのような手術は部分的 (乳房切除術)、四分円内 (四分円切除術)、扇形的、完全的 (乳房切除術)、全体的 (リンパ節、胸筋、血管、肋骨を含む腺の除去)、または緩和的 (胸部切除術) のいずれかになります。進行した形態のがん)。 この介入はメスまたはサイバーナイフを使用して実行され、組織にガンマ線を追加照射します。
放射線治療。手術前に、腫瘍の体積と周囲組織の腫れを減らすために処方されます。 術後は、ホルモン依存性がんの再発を予防するために使用されます。 手術後の放射線療法は、リンパ節でがん細胞が検出された場合に直接適応となります。 手術不能な形態の病気では、腫瘍の成長を遅らせ、患者の延命に役立ちます。 放射線の面積と治療線量は、プロセスの分布面積と患者の状態を考慮して計算されます。
化学療法。活発に増殖している細胞を破壊し、新生物のサイズを縮小し、再発を防ぐことを目的としています。 腫瘍組織と他の活発に増殖する細胞 (骨髄、免疫系、毛包、表皮) は両方とも化学療法に対して感受性があります。 細胞増殖抑制剤は通常、生殖年齢の女性および所属リンパ節が肥大している患者に処方されます。 転移のリスクが低い閉経前および閉経後の女性には、この方法は適応されません。
ホルモン療法。このタイプの乳がんはホルモンに敏感であるため、がん細胞のホルモン受容体に作用する薬剤が治療に使用され、良好な効果が得られます。 性ホルモンの合成または機能をブロックする薬は、5 cm を超える腫瘍を除去するための術前準備中、および他の形態の疾患の手術後に推奨されます。 生殖年齢であれば、卵巣摘出術が可能です。 ホルモン療法の使用により、生存予後が 25% 改善されます。
乳腺の部分的、完全または完全な切除に関連して生じる心理的および審美的問題を軽減するために、再建形成手術が行われます。 これらは、治療の全段階の完了後に遅らせて実行することも、乳房切除直後に一段階で実行することもできます。 術後の経過を改善するために、患者には食事の修正と合併症の薬物予防(骨粗鬆症を防ぐためのカルシウムサプリメントの処方、肝保護剤の処方)が処方されます。 重度の感情障害の場合は、精神科医に相談し、抗うつ薬や抗不安薬を処方する必要があります。