Микротрубочки принимают участие в поддержании формы клетки и служат направляющими «рельсами» для транспорта органоидов. Вместе с ассоциированными белками (динеин, кинезин) микротрубочки способны осуществлять механическую работу, например транспорт митохондрий, движение ресничек (трихомоподобных выростов клеток в эпителии легких, кишечника и яйцеводов) и биение жгутика сперматозоида. Кроме того, микротрубочки выполняют важные функции во время деления клеток.
Схема строения микротрубочки
Реснички, жгутики, клеточный центр, центриоли
Реснички и жгутики - органоиды специального назначения, выполняющие двигательную функцию и выступающие из клетки. Различий в ультрамикроскопическом строении ресничек и жгутиков нет. Жгутики отличаются от ресничек лишь длиной. Длина ресничек составляет 5-10 мкм, а длина жгутиков может достигать 150 мкм. Диаметр их составляет около 0,2 мкм. Одноклеточные организмы, имеющие реснички и жгутики, обладают способностью к движению. Неподвижные клетки, благодаря движению ресничек, способны перемещать жидкости и частички веществ.
Строение аксонемы реснички

Ресничка представляет собой тонкий цилиндрический вырост цитоплазмы, покрытый цитоплазматической мембраной.
Внутри выроста расположена аксонема (осевая нить), состоящая в основном из микротрубочек. В основании реснички находится базальное тело, погруженное в цитоплазму. Диаметры аксонемы и базального тельца одинаковы (около 150 нм).
Базальное тельце состоит из 9 триплетов микротрубочек и имеет "ручки". Часто в основании реснички лежит не одна, а пара базальных телец, располагающихся под прямым углом друг к другу, подобно центриоли.
Аксонема в отличие от базального тельца или центриоли имеет 9 дублетов микротрубочек с "ручками", образующих стенку цилиндра аксонемы. Кроме периферических дублетов микротрубочек, в центре аксонемы располагается пара центральных микротрубочек.
В целом систему микротрубочек реснички описывают как (9 х 2) + 2 в отличие от (9 х 3) + 0 системы центриолей и базальных телец. Базальное тельце и аксонема структурно связаны друг с другом и составляют единое целое: две микротрубочки триплетов базального тельца являются микротрубочками дублетов аксонемы.
Для объяснения способа движения ресничек и жгутиков используется гипотеза "скользящих нитей". Считается, что незначительные смещения дублетов микротрубочек друг относительно друга могут вызвать изгиб всей реснички. Если такое локальное смещение будет происходить вдоль жгутика, то возникает волнообразное движение.
Строение центриоли

Клеточный центр, или центросома, представляет собой немембранный органоид, локализованный около ядра и состоящий из двух центриолей и центросферы. Постоянным и наиболее важным компонентом клеточного центра являются центриоли. Этот органоид обнаружен в клетках животных, низших растений и грибов.
Центриоли (от лат. centrum - срединная точка, центр) представляют собой два перпендикулярно расположенных друг к другу цилиндра, стенки которых образованы микротрубочками и соединены системой связок. Конец одного цилиндра (дочерняя центриоль) направлен к поверхности другого (материнская центриоль). Совокупность сближенных между собой материнской и дочерней центриолей называется диплосомой. Впервые центриоли были обнаружены и описаны в 1875 г. В. Флемингом. В интерфазных клетках центриоли часто располагаются возле комплекса Гольджи и ядра.
Стенка центриолей состоит из расположенных по окружности 9 триплетов микротрубочек, образующих полый цилиндр. Систему микротрубочек центриоли можно описать формулой (9X3) + 0, подчеркивая отсутствие микротрубочек в центральной части. Диаметр центриоли составляет около 0,2 мкм, длина - 0,3-0,5 мкм (однако, есть центриоли, достигающие в длину нескольких микрометров). Кроме микротрубочек в состав центриоли входят дополнительные структуры - "ручки", соединяющие триплеты.
Центросфера - плотный слой цитоплазмы вокруг центриолей, в котором часто содержатся микротрубочки, расположенные лучами.
Центриолярный цикл. Строение и активность центриолей меняются в зависимости от периода клеточного цикла. Это позволяет говорить о центриолярном цикле. В начале периода G1 от поверхности материнской центриоли начинается рост микротрубочек, которые растут и заполняют цитоплазму. По мере роста микротрубочки теряют связь с областью центриолей и могут находиться в цитоплазме длительное время.
В периоде S или G2 происходит удвоение числа центриолей. Этот процесс заключается в том, что центриоли в диплосоме расходятся и около каждой из них происходит закладка процентриолей. В начале вблизи и перпендикулярно исходной центриоли закладываются девять одиночных микротрубочек. Затем они преобразуются в девять дуплетов, а потом в девять триплетов микротрубочек новых центриолей. Этот способ увеличения числа центриолей был назван дупликацией. Следует отметить, что удвоение числа центриолей не связано с их делением, почкованием или фрагментацией, а происходит путем образования процентриолей. Таким образом, в результате дупликации в клетке содержатся четыре попарно связанные центриоли. В этом периоде материнская центриоль продолжает играть роль центра образования цитоплазматических микротрубочек.
В периоде G2 обе материнские центриоли покрываются фибриллярным гало (зона тонких фибрилл), от которого в профазе начнут отрастать митотические микротрубочки. В этом периоде в цитоплазме происходит исчезновение микротрубочек и клетка стремится приобрести шаровидную форму. В профазе митоза диплосомы расходятся к противоположным полюсам клетки. От фибриллярного гало материнской центриоли отходят микротрубочки, из которых формируется веретено деления митотического аппарата. Таким образом, центриоли являются центрами организации роста микротрубочек. В телофазе происходит разрушение веретена деления.
Следует отметить, что в клетках высших растений, некоторых водорослей, грибов, ряда простейших центры организации роста микротрубочек центриолей не имеют. У некоторых простейших центрами индукции образования микротрубочек выступают плотные пластинки, связанные с мембраной.
Отдельную группу белков цитоскелета составляют белки микротрубочек. К ним относятся тубулин, белки, ассоциированные с микротрубочками (МАР 1, МАР 2, МАР 4, тау и др.) и белки - транслокаторы (динеин, кинезин, динамин). Микротрубочки – это белковые трубчатые структуры диаметром около 25 нм и длиной до нескольких десятков микрометров; толщина их стенок – около 6 нм. Они являются обязательным компонентом цитоплазмы эукариотических клеток. Микротрубочки образуют веретено деления (ахроматиновую фигуру) в митозе и в мейозе, аксонему (центральную структуру) подвижных ресничек и жгутиков, стенку центриолей и базальных телец. Микротрубочкам отводится важная, если не ключевая, роль в клеточном морфогенезе и в некоторых видах клеточной подвижности.
Стенки микротрубучек построены из белка тубулина, на долю которого приходится 90% по весу. Тубулин – это глобулярный белок, существующий в виде димера α- и β-субъединиц с молекулярной массой ~55 кДа. Микротрубочка имеет форму полого цилиндра, стенка которого состоит из линейных цепочек тубулиновых димеров, так называемых протофиламентов. В протофиламентах α- субъединица предыдущего димера соединена с β-субъединицей следующего. Димеры в соседних протофиламентах смещены друг относительно друга, образуя спиральные ряды. На попереченом срезе видно 13 димеров тубулина, что соответствует 13 протофиламентам в
стенке микротрубочки (рис. 9). Каждая субъединица содержит около 450 аминокислот и аминокислотные последовательности субъединиц гомологичны друг другу примерно на 40%. Тубулин – ГТФсвязывающий белок, причем β-субъединица содержит лабильно связанную молекулу ГТФ или ГДФ, способную обмениваться с ГТФ в растворе, а α-субъединица – прочно связанную молекулу ГТФ.
Рис. 9. Строение микротрубочки.
Тубулин способен к спонтанной полимеризации in vitro . Такая полимеризация возможна при физиологических температурах и благоприятных ионных условиях (отсутствие ионов Ca2+ ) и требует наличия двух факторов: высокой концентрации тубулина и присутствия ГТФ. Полимеризация сопровождается гидролизом ГТФ, и тубулин в составе микротрубочки остается связанным с ГДФ, а неорганический фосфат выходит в раствор.
Полимеризация тубулина состоит из двух фаз: нуклеации и элонгации. При нуклеации происходит формирование затравок, а при
элонгации – их удлинение с образованием микротрубочек. Следует отметить, что при полимеризации тубулина субъединицы добавляются только по концам микротрубочек.
Противоположные концы микротрубочек различаются по скоростям роста. Быстрорастущий конец принято называть плюсконцом, а медленнорастущий – минус-концом микротрубочки (см. рис. 9). В клетке (–)-концы микротрубочек, как правило, ассоциированы с центросомой, а (+)-концы направлены к периферии и нередко доходят до самого края клетки.
Микротрубочки подвержены динамической нестабильности.
При постоянном количестве полимера происходит спонтанный рост или укорочение отдельных микротрубочек вплоть до полного их исчезновения. Из-за запаздывания гидролиза ГТФ по отношению к встраиванию тубулина на конце микротрубочки, находящейся в процессе роста, формируется ГТФ-кэп, состоящий из 9-18 молекул ГТФ-тубулина. ГТФ-кэп стабилизирует конец микротрубочки и способствует ее дальнейшему росту. Если же скорость включения новых гетеродимеров оказывается меньше скорости гидролиза ГТФ или в случае механического разрыва микротрубочки, образуется конец, лишенный ГТФ-кэпа. Такой конец обладает пониженным сродством к новым молекулам тубулина; он начинает разбираться.
Полимеризацию и деполимеризацию микротрубочек индуцируют изменениями температуры, ионных условий или использованием специальных химических агентов. Среди веществ, вызывающих необратимую разборку, широко используются индольные алкалоиды (колхицин, винбластин, винкристин и др.).
БЕЛКИ, АССОЦИИРОВАННЫЕ С МИКРОТРУБОЧКАМИ
Белки, ассоциированные с микротрубочками, делятся на две группы: структурные МАР (microtubule-associated proteins) и белки-
транслокаторы.
Структурные МАР
Общим свойством структурных МАР является их перманентная ассоциация с микротрубочками. Еще одним общим свойством этой группы белков является то, что в отличие от белков-транслокаторов при взаимодействии с тубулином все они связываются с С-концевой частью молекулы размером около 4 кДа.
Различают высокомолекулярные МАР 1 и МАР 2, белки тау с молекулярной массой порядка 60-70 кДа и МАР 4 или МАР U с молекулярной массой около 200 кДа.
Так, молекула МАР 1В (представитель группы белков МАР 1) – это стехиометрический комплекс одной тяжелой и двух легких цепей, представляет собой вытянутую палочкообразную молекулу длиной 190 нм, имеющую на одном конце глобулярный домен диаметром 10 нм (по-видимому, участок связывания с микротрубочками); его молекулярная масса составляет 255.5 кДа.
МАР 2 – термостабильный белок. Он сохраняет способность взаимодействовать с микротрубочками и оставаться в их составе в нескольких циклах сборки-разборки после нагревания до 90о С.
Структурные МАР способны стимулировать инициацию и элонгацию и стабилизировать готовые микротрубочки; сшивать микротрубочки в пучки. В таком сшивании участвуют короткие α-
спиральные гидрофобные последовательности на N-конце МАР и тау, замыкающие молекулы МАР, сидящие на соседних микротрубочках, наподобие застежки «молния». Биологическая роль такого сшивания может состоять в стабилизации структур, образованных микротрубочками в клетке.
На сегодняшний день экспериментальными исследованиями установлено, что помимо регуляции динамики микротрубочек структурные МАР имеют еще две основные функции: клеточный морфогенез и участие во взаимодействии микротрубочек с другими внутриклеточными структурами.
Белки-транслокаторы
К отличительной особенности белков этой группы относится свойство преобразовывать энергию АТФ в механическое усилие, способное перемещать частицы вдоль микротрубочек или микротрубочки вдоль субстрата. Соответственно транслокаторы являются механохимическими АТФазами, и их АТФазная активность стимулируется микротрубочками. В отличие от структурных МАР, транслокаторы ассоциированы в микротрубочками только в момент АТФ-зависимого перемещения.
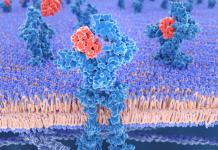
Белки-транслокаторы делятся на две группы: кинезиноподобные белки (опосредуют движение от (–)-конца к (+)-концу микротрубочек) и динеинопободные белки (движение от (+)-конца к (–)- концу микротрубочек) (рис. 10).
Кинезин представляет собой тетрамер двух легких (62 кДа) и двух тяжелых (120 кДа) полипептидных цепей. Молекула кинезина

имеет форму стержня диаметром 2-4 нм и длиной 80-100 нм с двумя глобулярными головками на одном конце и веерообразным расширением на другом (рис. 11).
Рис. 10. Белки-транслокаторы.
В середине стержня находится шарнирный участок. N-Концевой фрагмент тяжелой цепи размером около 50 кДа, обладающий механохимической активностью, называется моторным доменом кинезина.
Рис. 11. Строение молекулы кинезина.
Строение и функции микротрубочек.
Одним из обязательных компонентов цитоплазмы растительной клетки являются микротрубочки. В морфологическом отношении микротрубочки представляют собой длинные полые цилиндры с внешним диаметром 25 нм. Стенка микротрубочек состоит из полимеризованных молекул белка тубулина. При полимеризации молекулы тубулина образуют 13 продольных протофиламентов, которые скручиваются в полую трубку. Размен мономера тубулина составляет около 5 нм, равного толщине стенки микротрубочки, в поперечном сечении которой видны 13 глобулярных молекул.
Микротрубочка является полярной структурой, имеющей быстро растущий плюс-конец и медленно растущий минус-конец.
Микротрубочки являются очень динамичными структурами, которые могут достаточно быстро возникать и разбираться. При использовании электронных систем усиления сигнала в световом микроскопе можно видеть, что в живой клетке микротрубочки растут, укорачиваются, исчезают, т.е. постоянно находятся в динамической нестабильности. Оказалось, что среднее время полужизни цитоплазматических микротрубочек составляет всего лишь 5 минут. Так за 15 мин около 80% всей популяции микротрубочек обновляется. В составе веретена деления микротрубоски имеют время жизни около 15-20 с. Однако 10-20% микротрубочек остаются относительно стабильными достаточно долгое время (до нескольких часов).
Сами микротрубочки не способны к сокращению, однако они являются обязательными компонентами многих движущихся клеточных структур, таких как веретено клетки во время митоза как микротрубочки цитоплазмы, которые обязательны для целого ряда внутриклеточных транспортов, таких как экзоцитоз, движение митохондрий и др.
В целом роль цитоплазматических микротрубочек может быть сведена к двум функциям: скелетной и двигательной. Скелетная, каркасная, роль заключается в том, что расположение микротрубочек в цитоплазме стабилизирует форму клетки. Двигательная роль микротрубочек заключается не только в том, что они создают упорядоченную, векторную систему движения. Микротрубочки цитоплазмы а ассоциации со специфичными ассоциированными моторными белками образуют АТФазные комплексы, способные приводить в движение клеточные компоненты. Кроме того, микротрубочки участвуют в процессах роста клеток. У растений, в процессе растяжения клеток, когда за счет увеличения центральной вакуоли происходит значительный рост объема клеток, большие количества микротрубочек появляются в периферических слоях цитоплазмы. В этом случае микротрубочки, так же как и растущая в это время клеточная
стенка, как бы армируют, механически укрепляют цитоплазму.
Химический состав микротрубочек
Микротрубочки состоят из белков-тубулинов и ассоциированных с ними белков. Молекула тубулина представляет собой гетеродимер, состоящий из двух разных субъедениц: из
иПри достаточной концентрации белка полимеризация происходит спонтанно. При спонтанной полимеризации тубулинов осуществляется гидролиз одной молекулы ГТФ, связанной с
- тубулином. Во время наращивания длины микротрубочки связывание тубулинов идет с большей скоростью на растущем плюс-конце. Но при недостаточной концентрации тубулина микротрубочки могут разбираться с обоих концов. Разборке микротрубочек способствуют понижение температуры и наличие ионов Са 2 .Существует ряд веществ, которые влияют на полимеризацию тубулина. Так, алкалоид колхицин, связывается с отдельными молекулами тубулина и рпедотвращает их полимеризацию. Это приводит к падению концентрации свободного тубулина, способного к полимеризации, что вызывает быструю разборку цитоплазматических микротрубочек и микротрубочек веретена деления. Таким же действием обладают колцемид и нокодозол, при отмывании которых происходит полное восстановление микротрубочек.
Стабилизирующим действием на микротрубочки обладает таксол, который способствует полимеризации тубулина даже при его низких концентрациях.
Также в составе микротрубочек обнаруживаются ассоциированные с ними дополнительные белки, так называемые МАР-белки. Эти белки, стабилизируя микротрубочки, ускоряют процесс полимеризации тубулина.
Строение и функции микрофиламентов
Микрофиламенты представляют собой очень тонкие и длинные нитевидные белковые структуры, встречающиеся во всей цитоплазме. Под плазматической мембраной микрофиламенты образуют сплошное сплетение, формируя цитосклет. Вся эта структура очень лабильна. Под влиянием различных воздействий (большое значение имеет концентрация кальция) микрофиламенты распадаются на отдельные фрагменты и вновь собираются. Так как микрофиламенты являются сократимыми элементами цитоскелета, то участвуют в изменении формы клетки, во внутриклеточных перемещениях органелл, расхождении хромосом при делении клетки. Кроме этого микрофиламиенты выполняют исследующие функции:
Ответственны за перемещение: хлоропластов, которые могут изменять свое положение в зависимости от освещения;
Клеточных ядер;
Пузырьков;
Участвуют: в фагоцитозе (но, не в пино- или экзоцитозе); в образовании перетяжки при клеточном делении (здесь действует кольцо из пучков микрофиламентов, опоясывающих клетку); в движении хроматид и хромосом при делении ядра.
Внутриклеточное движение возникает при взаимодействии микрофиламентов из актина (актиновых нитей) с миозином.
Химический состав микрофиламентов
В состав микрофиламентов входит в основном белок актин. Но кроме него входят миозин, актинин и др.
Актин - глобулярный белок, он составляет 5-15 % всего клеточного белка и является важнейшим белком эукариотических клеток. Глобулярный актин (гамма-актин) полимеризуется в актиновые филаменты (F-актин), состоящие из двух закрученных друг около друга спиралей (диаметр - около 6 нм, длина - несколько мкм). Актин образует трехмерную сеть из большого числа нитей или пучки не менее чем из 20 нитей. В клетке существует обратимое равновесие: гамма-актин - F-актин - пучки F-актина.
Миозин в эукариотических клетках содержится в меньшем количестве (0,3-1,5 % клеточного белка), чем актин. Нитевидная молекула миозина (молекулярная масса более 450 000, длина 150 нм) состоит из двух больших и нескольких малых субъединиц, образующих длинную двойную спираль. Один конец этой спирали несет две головки. Конец с головками катализирует расщепление АТФ (миозиновая АТФаза) и может специфически связываться с актином. Актин активирует АТФазу. При расщеплении АТФ освобождается энергия, необходимая для внутриклеточных движений.
Заключение
Клеточная стенка растений выполняет ряд важных функций. Окружая растительную клетку со всех сторон, она служит связующим звеном между ней и соседними клетками. Соединяясь между собой тонкими нитями цитоплазмы – плазмодесмами, через которые осуществляется перемещение веществ из клетки в клетку.
Благодаря тому, что первичная оболочка эластична, клетка в этот период интенсивно растет. После прекращения роста образуется вторичная оболочка, в состав которой входит лигнин и ряд других веществ - придающий клетке прочность, жесткость. Эти свойства особенно важны для наземных растений: во-первых, это прочный «скелет», во-вторых, защита от избыточной потери воды. Клеточная оболочка прозрачна, поэтому солнечные лучи легко проникают внутрь клетки к хлоропластам.
Цитоскелет представляет собой белковые, неветвящиеся полимеры, участвующие в процессе перемещения клеточных компонентов, а также выполняют каркасную скелетную роль. Также эти компоненты участвуют в процессе деления клетки, формируя нити веретена деления.
Из выше перечисленного видно, что данные компоненты клетки играют важную
Список литературы
1. Андреева Т.Ф. Маевская С.Н. Воеводская С.Ю. «Физиология растений»
2.Головко Т.К. Добрых Е.В. «Физиология растений» 1993г.
3. Фрей-Виссменг А. Мюлеталер К. «Ультраструктура растительной
клетки» 1968г.
4. Ченцов Ю.С. «Введение в клеточную биологию», М. Академкнига,
5. Якушкина Н.И. Бахтенко Е.Ю. «Физиология растений», М. Владос
6. www.ido.tsu.ru
7. http://www.medkurs.ru/lecture1k/med_biology/qm31/2499.htm
8. http://school.iot.ru/predmety/biologiya.doc
Цитоскелет состоит из полимеров белковой природы. Каждый полимер состоит из нескольких тысяч идентичных субъединиц, связанных вместе с образованием филаментов
Цитоскелет обеспечивает движение клеток и их механическую поддержку
Клеточный цитоскелет состоит из трех типов полимеров: актиновые филаменты, промежуточные филаменты и микротрубочки
Все полимеры имеют динамическую природу; они постоянно наращивают и теряют субъединицы
Микротрубочки представляют собой полимеры субъединиц тубулина
Микротрубочки почти всегда функционируют вместе с молекулярными моторами, которые генерируют усилия, осуществляя движение везикул и других комплексов по поверхности микротрубочек
Реснички и жгутики представляют собой специализированные органеллы, состоящие из и моторных белков, которые обеспечивают движение клеток в жидкой среде или движение жидкости вдоль клеточной поверхности
Химические соединения, разрушающие микротрубочки, применяются в медицине и в сельском хозяйстве
Фотография представляет собой кадр видеоизображения.Виден небольшой участок цитоплазмы клетки млекопитающих.
Слева внизу виден край клетки; ядро находится справа вверху и не видно в кадре.
Видеосъемка показывает, что большая часть везикул находится в постоянном движении.
Цитоплазма эукариотических клеток находится в постоянном движении, поскольку органеллы все время перемещаются с места на место. Это движение особенно заметно в цитоплазме крупных клеток удлиненной формы, таких как нейроны.
Движение цитоплазмы отмечается также и в других клетках. Движение органелл необходимо для выполнения ряда функций. Секреторные везикулы выходят из аппарата Гольджи, который расположен в середине клетки, и транспортируются к плазматической мембране, где экскретируют свое содержимое в межклеточную среду. В то же время везикулы, интернализованные в мембрану, транспортируются в эндосомы. Митохондрии все время находятся в движении, а ЭПР постоянно растягивается и реорганизуется.
В митотических клетках хромосомы вначале выстраиваются в метафазную пластинку, а затем расходятся в противоположные стороны. Движение органелл и хромосом в правильном направлении и в надлежащее время обеспечивается цитоскелетом, который представляет собой белковые структуры, формирующие рельсовую транспортную систему клетки и моторных белков, двигающихся по ним.
Цитоскелет также обладает другими важными функциями : он обеспечивает подвижность клеток, а также необходим для организации и структурной поддержки формы всех клеток. Многие клетки движутся или самостоятельно, например находясь в организме (клетки животных), или перемещаясь с током окружающей среды (одноклеточные организмы и гаметы).
Клетки, подобные белым кровяным клеткам , которые находят и разрушают патогенные бактерии, способны перемещаться по плоской поверхности. Другие, например сперматозоиды, чтобы достигнуть места назначения, передвигаются в жидкой среде. Цитоскелет обеспечивает все формы такого движения клеток и его направление. Наряду с кинематической функцией, цитоскелет обеспечивает организацию внутренней структуры клетки и формирует верхнюю и нижнюю, левую и правую, а также переднюю и заднюю ее части.
Определяя общую характеристику цитоплазмы , цитоскелет задает общую форму клетки, образуя прямоугольные эпителиальные клетки, нейроны с длинными тонкими аксонами, и дендриты, которые у человека в длину могут достигать одного метра.
 Три кадра видеоизображения аксона живого нейрона.
Три кадра видеоизображения аксона живого нейрона.
На верхнем кадре схематически изображена вся нервная клетка.
Три везикулы, помеченные красной, желтой и голубой стрелками, наблюдались на протяжении 6 с.
Две везикулы движутся в направлении конца аксона, а одна в направлении тела клетки.
Цитоскелет состоит из трех основных типов структурных элементов : микротрубочек, микрофиламентов. Эти три типа структур, представленные на рисунке ниже, имеют много общих свойств. Каждый белок функционирует не как самостоятельная молекула, а как полимер, состоящий из множества идентичных белковых субъединиц. Подобно тому, как бусины, нанизанные на нитку, образуют ожерелье, полимеры цитоскелета выстраиваются в цитоплазме, связывая между собой тысячи белковых субъединиц. Основная особенность всех полимеров цитоскелета состоит в том, что они не представляют собой статические структуры, а постоянно наращивают и теряют субъединицы. Такая динамичная природа полимеров цитоскелета позволяет осуществлять его реорганизацию, образовывать новые или способствовать функционированию существующих транспортных путей в соответствии с внутриклеточными нуждами.
Хотя все три типа структурных белков проявляют общие свойства, каждый из них обладает уникальностью, что делает его наиболее соответствующим выполнению определенных задач в клетке. Поэтому три типа полимеров будут рассмотрены отдельно, хотя они часто функционируют совместно.
Эта и следующие статьи на сайте посвящаются микротрубочкам. Основная субъединица, образующая микротрубочки, представляет собой белок тубулин. Соединяясь между собой, молекулы тубулина образуют полые трубочки около 25 нм в диаметре. Отсюда они получили свое название. Одна микротрубочка может содержать десятки и сотни тысяч молекул тубулина и в длину достигать нескольких микрон.
Таким образом, микротрубочки способны распространяться более чем на половину длины большинства эукариотических клеток. Обычно интерфазные клетки содержат сотни длинных микротрубочек, проходящих через цитоплазму и соединяющих различные области клетки.
Почти всегда функционируют совместно с молекулярными моторами, которые по ним продвигаются. Эти моторные белки присоединяются к различным грузам, включая органеллы и везикулы, и транспортируют их по поверхности микротрубочек, подобно тому, как грузовики движутся по шоссейным дорогам. Микротрубочки и моторные белки также функционируют вместе при разделении реплицированных хромосом в митозе и образуют основу подвижных структур, которые используются клеткой для перемещения в жидкости или для обеспечения движения жидкости вдоль ее поверхности. Микротрубочки и моторные белки даже используются вирусами, например ВИЧ и аденовирусами, для того чтобы они могли быстро достигнуть ядра и реплицироваться.
Небольшие молекулы органических соединений , которые нарушают полимеризацию микротрубочек, используются в медицине и в сельском хозяйстве. Вещества, в той или иной степени способные стабилизировать микротрубочки, блокируют митоз и применяются как средства для лечения рака. Одним из таких веществ является паклитаксел (Таксол™), формула которого представлена на рисунке ниже и который используется для лечения рака яичников и молочной железы. Таксол связывается с микротрубочками и стабилизирует их, предотвращая диссоциацию субъединиц тубулина. Колхицин представляет собой еще один яд, оказывающий на микротрубочки противоположный эффект, т. е. вызывает их диссоциацию.
Препарат используется для лечения подагры, поскольку разрушение микротрубочек блокирует миграцию белых кровяных клеток, ответственных за воспалительный процесс при этом заболевании. Низкомолекулярные вещества, влияющие на тубулин, находят важное применение в сельском хозяйстве. Например, Зоксамид™ является фунгицидом, который специфически связывается с тубулинами грибков, тем самым предотвращая их рост. Препарат используется для борьбы с поздним фузариозным увяданием картофеля, грибковым заболеванием, которое вызвало массовый неурожай картофеля в Ирландии в 1850 г В настоящее время активно проводится поиск новых препаратов, способных связываться с тубулином и могущих найти применение в медицине и сельском хозяйстве.
 Участок фибробласта в электронном микроскопе (слева). Видны многочисленные филаменты.
Участок фибробласта в электронном микроскопе (слева). Видны многочисленные филаменты.
На снимке справа три типа полимеров, из которых состоит цитоскелет эукариотической клетки, выделены различным цветом.
 Микротрубочки в фибробласте. Для визуализации микротрубочек клетки обрабатывали красителем, флуоресцирующим зеленым цветом.
Микротрубочки в фибробласте. Для визуализации микротрубочек клетки обрабатывали красителем, флуоресцирующим зеленым цветом.
Микротрубочки организованы вокруг центральной точки (помеченной красным цветом) и распространяются в цитоплазму.
Большинство микротрубочек обладает достаточной длиной для того, чтобы проникнуть из одной части клетки в другую.
 Строение трех небольших органических молекул, нарушающих процесс сборки или разборки микротрубочек.
Строение трех небольших органических молекул, нарушающих процесс сборки или разборки микротрубочек.
Паклитаксел (Таксол) и колхицин представляют собой природные продукты, образующиеся в некоторых растениях (тихоокеанский тис и безвременник осенний соответственно).
Зоксамид является синтетическим веществом, которое было обнаружено при скрининге большого числа различных низкомолекулярных соединений по тесту нарушения функционирования микротрубочек.
Время полужизни микротрубочки ~5 мин, во время первой половины митоза ~15c
Диаметр микротрубочки 25нм.
Образование микротрубочек
Структурной единицей микротрубочки является гетеродимер белка тубулина , состоящий из α- и β-субъединиц (53 и 55 кДа), не прибывающих по отдельности, схожие но не идентичные. Каждая из субъединиц имеет сайт для связывания нуклеотида. α-тубулин связывает молекулу GTP, которая не гидролизуется, β-тубулин может связывать GDP или GTP (рис.1). β-тубулин одного гетеродимера связывает GTP и соединяется с α-тубулином другого гетеродимера, при этом GTP гидролизуется до GDP. α-тубулин является GTP-активирующим белком и катализирует гидролиз GTP β-тубулина (рис.2). Таким образом гетеродимеры образуют линейные цепочки – протофиламенты, 13 протофиламентов образуют спиральный циклический комплекс, такие кольца полимеризуются в трубку (рис.3). Фосфорилирование тубулина усиливает полимеризацию.
Рис.1 Гетеродимер тубулина. α-тубулин (син.) с сайтом связывания GTP (голуб.). β-тубулин (зел.) с сайтами связывания GTP и GDP (красн.)
Микротрубочки - динамические полярные стр-ры. (+)-конец динамически нестабильный (β-тубулин) и (-)-конец стабилизируется, связываясь с центром организации микротрубочек (см. обзор Центросома).
Тредмиллинг - движение микротрубочек в результате одновременного наращивания одного конца и диссоциации другого конца микротрубочек.
ДНК тубулина в нуклеотид-связывающем домене имеет высококонсервативную последовательность GGGTG(T/S)G.
Бактериальный белок FtsZ - гомолог тубулина является компонентом бактериального цитоскелета и полимеризуется с образованием микротрубочек.
 Микротрубочки
Микротрубочки
рис.2 Микротрубочки способны образовывать синглет, дублет и триплет.
A микротрубочка дублета или триплета состоит из 13 протофиламентов.
Трубочки B и C состоят из меньшего числа протофиламентов, обычно 10.
Белки соединяющиеся с микротрубочками.
С микротрубочками ассоциируют два вида белков: структурныерные
белки (MAP-microtubuls-associated proteins) и белки транслокаторы.
Присоединение MAP регулируется фосфорилированием, в результате
которого некоторые MAP отсоединяются от микротрубочек.
+TIPS
- белки взаимодействующие с (+)-концом
микротрубочки, многие из которых являются моторными белками,
другие обеспечивают взавимодействие с микрофиламентами в
клеточном кортексе, присоединяя микротрубочки к плазматической
мембране. Некоторые +TIPS регулируют динамику микротрубочек
и стабильность (+)-конца, например, XMAP215
семейство белков стабилизирует (+)-конец предотвращая разрушение
и обеспечивая рост микротрубочек.
CLASP
- белки обеспечивающие присоединение
димеров тубулина к (+)-концу и ингибируют катастрофины
.
Они взаимодействуют с кинетохором - комплексом который соединяет
(+)-конец микротрубочки с хромосомой.
Катастрофины - +TIP белки связывающиеся с (+)-концом микротрубочек
и обепечивающие диссоциацию димеров тубулина. Они способны
активировать гидролиз GTP или изменение конформации протофиломентов
(MCAK
- кинезин, располагающийся в кинетохоре
и обеспечивает диссоциацию (+)-конца во время анафазы митоза).
Стасмин
- дестабилизирующий белок, находящийся
в раковых клетках. Присоединяется с тубулиновым гетеродимером
затрудняя их полимеризацию. Стасмины ингибируются фосфорилированием.
Катанин - разделяет микротрубочки образуя новый нестабильный
(+)-конец.
НекоторыеMAP соединяют микротрубочки
друг с другом, с мембраной или промежуточными филаментами.
Тип I MAP обнаружен в аксонах и дендритах нервных клеток
и некоторых других имеет несколько повторов KKEX (Lys-Lys-Glu-X)
которые связывают (-)-заряженные участки тубулина.
Тип II MAP также обнаружен в аксонах и дендритах нервных
клеток и некоторых других. Они имеют 3-4 повтора из 18 остатков
последовательности, которая присоединяет тубулин.
Белки взаимодействующие с (+)-концом микротрубочек
APC, Kar9 (Sc )*
APC (adenomatous polyposis coli) - опухолевый супрессор,
являющийся основой для белкового комплекса регулирующего
фосфорилирование b-катенинов.
EB1, Bim1 (Sc), Mal3 (Sp)
EB1 (end-binding protein 1) - белок взаимодействующий с
APC.
Nud (An)
Nud (nuclear distribution) - белок регулирующий динеины.
Lis1/NUDF (An), Pac1 (Sc )
Lis (lissencephaly) - нарушение развития человеческого мозга
(гладкий мозг). Белок взаимодействует с динеином регулируя
его функцию.
NUDE
(An), R011
(Neurospora
crassa)/Ndl1
(Sc); Nde1, Ndel1
(млекопитающие).
Эти белки взаимодействуют с Lis1 и денеинами и обеспечивают
их функционирование.
Kar3 (Sc)
Kar3 - кинезин, имеющий C-концевой моторный домен и пренадлежит
к семейству Kinesin-14.
Kip2
(Sc
), Tea2
(Sp
), KipA
(An
)
Кинезины грибов принадлежащие семейству Kinesin-7 включающее
CENP-E - центромерный белок млекопитающих, Kip2 , Tea2 and
KipA
Klp10A (Dm), Klp59C, MCAK
Члены семейства Kinesin-13. Klp10A - предполагаемый гомолог
Kif2A млекопитающих. Klp59C (Dm) - предпоплагаемый гомолог
MCAK млекопитающих. KLP10A и другие члены Kin I
субсемейства кинезинов взаимодействующих с некепированным
(-)-концом микротрубочек веретена деления во время митоза.
Они обеспечивают диссоциацию тубулиновых димеров полюсов
клетки, способствуя тедмиллингу
(движению
микротрубочек к полюсам и укорочение микротрубочек во время
анафазы митоза).
Dynactin
Комплекс белков включающий белок p150glued. Динактин связывает
динеин и регулирует его свойства, а такжи присоединяет везикулы
к динеину. p150glued - гомолог NUDMA. nidulans.
CLIP-170, Bik1
(Sc
), Tip
(Sp
)
CLIP-170 обеспечивает стабилизацию и рост микротрубочек,
а так же регулирует локализацию динеина.
СLIP-170 - обеспечивает посадку комплекса динеин-динактин,
участвующего в транспорте везикул, на конец микротрубочки.
LIP-170 находится в цитоплазме в неактивной конформации
в которой N-конец связывающийся с микротрубочкой связан
с С-концом той же молекулы. При связывании N-конца с тубулином
или (+)-концом микротрубочки, C-конец освобождается и связывается
с комплексом динеин-динактин через молекулу p150Glued, микротрубочка
стабилизируется. Диненин-динактин освобождается и начинает
движение вдоль микротрубочки (рис.3)
Некоторые токсины и лекарства, некоторые из которых нарушают митоз влияют на полимеризацию и деполимеризацию тубулина:
таксол - противоопухолевое лекарство, стабилизирует микротрубочки.
колхицин связывает тубулин блокируя полимеризацию. Микротрубочки деполимеризуются при высокой концентрации колхицина.
винбластин - усиливает деполимеризацию образуя паракристаллы винбластин-тубулин.
нокодазол - обеспечивает деполимеризацию микротрубочек.
Ассоциация подавляется винбластин, винкристин, колхицин, усиливается – таксол.
Гамма-сома – центр организующий микротрубочки на внешней поверхности ядра.