1) Рецепторный. Осуществляется с помощью «рецепторов смерти» при активирующем взаимодействии с соответствующими лигандами, большинство из которых относится к суперсемейству фактора некроза опухолей. Взаимодействие рецептора с лигандом приводит к активации адапторных белков, ассоциированных с «доменами смерти» (FADD - Fas-associated death domain, TRADD - TNF-R-associated death domain), и прокаспазы 8, продукт которой - каспаза 8 (инициаторная) активирует каспазу 3 (эффекторную), что, в свою очередь, обусловливает активацию эндонуклеаз, фрагментирующих ДНК.
2) Митохондриальный. Участие митохондрий в апоптозе обеспечивается присутствием в их матриксе и межмембранном пространстве большого количества биологически активных веществ (цитохрома С (Cyt С); прокаспаз 2, 3, 9; апоптозиндуцирующего фактора (AIF), обладающих выраженным апоптогенным действием. Фактором активации апоптоза является выход данных веществ в цитоплазму при снижении трансмембранного потенциала митохондрий вследствие открытия гигантских митохондриальных пор (выполняют роль Ca 2 +-, рН-, потенциал-, НАДФ2Н/НАДФ+- и редоксзависимых каналов) и повышения проницаемости митохондриальных мембран. К раскрытию пор приводят истощение в клетках восстановленного глутатиона, НАДФН, АТФ и АДФ, образование активных форм кислорода, разобщение окислительного фосфорилирования, увеличение содержания Ca 2 + в цитоплазме. Поступление межмембранных белков и активация апоптоза возможны также при разрыве наружной мембраны митохондрий вследствие гиперполяризации внутренней мембраны.
3) р53-опосредованный. p53 - многофункциональный белок, играющий важную роль в мониторинге сигналов о состоянии клетки, целостности ее генома, активности систем ДНК-репарации. Повреждение ДНК ведет к накоплению белка р53 в клетке. Это определяет остановку клеточного цикла в фазах G 1 и G 2 , предотвращает репликацию, активирует синтез и репарацию ДНК, а следовательно, создает условия для восстановления нативной структуры ДНК, препятствует появлению мутантных и анеуплоидных клеток в организме. В случае если имеется недостаточность систем ДНК-репарации и повреждения ДНК сохраняются, клетка подвергается апоптозу. В частности, белок р53 способен индуцировать транскрипцию таких апоптогенных факторов, как Bax, Fas- рецептор, DR-5 и др.
4) Перфорин-гранзимовый. Цитотоксические Т-лимфоциты (Т-киллеры) вызывают апоптоз клеток-мишеней (например, инфицированных клеток) с помощью белка перфорина. Полимеризуясь, перфорин образует в цитоплазматической мембране клеткимишени трансмембранные каналы, по которым внутрь клетки поступают секретируемые Т-киллером гранзимы (фрагментины) - смесь сериновых протеаз. Основным компонентом этой смеси является гранзим В - протеолитический фермент, активирующий каспазу 3.
Значение белков-регуляторов апоптоза в развитии организма и патологических процессах
Вcl-2 требуется для поддержания жизнеспособности лимфоцитов, меланоцитов, эпителия кишечника и клеток почек во время развития эмбриона.
Вcl-x необходим для ингибирования смерти клеток в эмбриогенезе, особенно в нервной системе.
Bax необходим для апоптоза тимоцитов и поддержания жизнеспособности сперматозоидов во время их развития.
р53 является геном супрессии опухолей, поэтому в эмбриогенезе особой роли не играет, но обязательно необходим для супрессии опухолевого роста.
Усиленный синтез белка, кодируемого bcl-2 геном, приводит к подавлению апоптоза и, соответственно, развитию опухолей; данный феномен обнаружен в клетках В-клеточной фолликулярной лимфомы.
При лимфопролиферативных заболеваниях и похожей на системную красную волчанку болезни у мышей наблюдается нарушение функции Fas-лиганда или Fas-рецептора.
Повышенный синтез Fas-лиганда предупреждает отторжение трансплантата.
Апоптоз является частью патологического процесса при инфицировании клетки аденовирусами, бакуловирусами, ВИЧ и вирусами гриппа.
Ингибирование апоптоза в клетке-хозяине наблюдается при персистировании инфекции, в латентном периоде, а при усиленной репликации аденовирусов, бакуловирусов, возможно герпесвирусов, вируса Эпштейн-Барра и ВИЧ наблюдается активация апоптоза в клетках иммунной системы, что способствует распространению вируса.
Введение
апоптоз смерть старение патологический
Апоптоз - физиологическая смерть клетки, представляющая собой своеобразную генетически запрограммированную самоликвидацию. Термин «апоптоз» в переводе с греческого означает «опадающий». Авторы термина дали такое название процессу запрограммированной смерти клеток потому, что именно с ним связано осеннее опадание увядших листьев. Кроме того, само название характеризует процесс как физиологический, постепенный и абсолютно безболезненный. У животных в качестве наиболее яркого примера апоптоза, как правило, приводят исчезновение хвоста у лягушки во время метаморфозы из головастика во взрослую особь. По мере взросления лягушонка хвост полностью исчезает, поскольку его клетки подвергаются постепенному апоптозу - запрограммированной смерти, и поглощению деструктированных элементов другими клетками. Явление генетически запрограммированной гибели клеток встречается у всех эукариотов (организмов, клетки которых имеют ядро). Прокариоты же (бактерии) имеют своеобразный аналог апоптоза. Можно сказать, что данный феномен характерен для всего живого, за исключением таких особых доклеточных форм жизни, как вирусы. Апоптозу могут подвергаться как отдельные клетки (как правило, дефектные), так и целые конгломераты. Последнее особенно характерно для эмбриогенеза. К примеру, опыты исследователей доказали, что благодаря апоптозу во время эмбриогенеза исчезают перепонки между пальцами на лапках у цыплят. Ученые утверждают, что у человека такие врожденные аномалии, как сросшиеся пальцы на руках и ногах, также возникают вследствие нарушения нормального апоптоза на ранних стадиях эмбриогенеза.
1. История открытия
Изучение механизмов и значения генетически программируемой клеточной смерти началось еще в шестидесятых годах прошлого века. Ученых заинтересовал тот факт, что клеточный состав большинства органов на протяжении жизни организма практически одинаков, а вот жизненный цикл различных типов клеток значительно отличается. При этом происходит постоянная замена многих клеток. Таким образом, относительное постоянство клеточного состава всех организмов поддерживается динамическим равновесием двух противоположных процессов - клеточной пролиферации (деление и рост) и физиологического отмирания отживших клеток. Авторство термина принадлежит британским ученым - Дж. Керру, Э. Уайли и А. Керри, которые впервые выдвинули и обосновали концепцию о принципиальном различии физиологической смерти клеток (апоптоз), и их патологической гибели (некроз). В 2002 году ученые из кембриджской лаборатории, биологи С. Бреннер, Дж. Салстон и Р. Хорвиц, получили Нобелевскую Премию по физиологии и медицине за раскрытие основных механизмов генетической регуляции развития органов и исследования программируемой клеточной смерти. Сегодня теории апоптоза посвящены десятки тысяч научных работ, раскрывающие основные механизмы его развития на физиологическом, генетическом и биохимическом уровнях. Ведется активный поиск его регуляторов. Особенно большой интерес представляют исследования, дающие возможность практического применения регуляции апоптоза при лечении онкологических, аутоиммунных и нейродистрофических заболеваний. В организме среднестатистического взрослого человека в результате апоптоза погибает ежедневно порядка 50-70 миллиардов клеток. Для среднестатистического ребёнка в возрасте от 8 до 14 лет число клеток, погибших путём апоптоза, составляет порядка 20-30 миллиардов в день. Суммарная масса клеток, которые на протяжении 1 года жизни подвергаются разрушению, эквивалентна массе тела человека. При этом восполнение утраченных клеток обеспечивается за счёт пролиферации - увеличения клеточной популяции путём деления.
Апоптоз человеческого лейкоцита
2. Механизм
Механизм развития апоптоза на сегодняшний день до конца не изучен. Доказано, что процесс может индуцироваться малыми концентрациями большинства веществ, вызывающих некроз. Однако в большинстве случаев генетически запрограммированная гибель клеток происходит при поступлении сигналов от молекул - клеточных регуляторов. В биохимическом механизме апоптоза выделяют 4 основных компонента: 1) CysAsp-протеазы илм каспазы; 2) так называемые «рецепторы серти» на поверхности клетки; 3) митохондрии и выходящий из них цитохром с и 4) специальные про-и антиапоптозные белки. Такие вторичные мессенджеры, как Са2+, активные формы кислорода (АФК) и окись азота (NO), также играют важную роль в апоптозе.
Каспазы (семейство CysAsp-протеаз) выполняют центральную роль в запуске апоптоза. У млекопитающих семейство каспаз состоит из 14 белков, постоянно синтезируемых практически во всех клетках в виде проферментов, активирующихся при апоптозе. Они принимают участие в развитии воспалительных процессов, а также, наряду с эффекторными каспазами, в пролиферации Т-лимфоцитов, терминальной дифференцировке эпителиальных клеток хрусталика и кератиноцитов.
Так называемые «рецепторы смерти». У млекопитающих апоптоз часто начинается с активации так называемых «индуцирующих смерть сигнальных комплексов» на плазматической мембране. Эти комплексы образуются при взаимодействии определенных внеклеточных лигандов - например, Fas или TNF (tumor necrosis factor) с белками семейства рецепторов фактора некроза опухолей (TNFR) на клеточной мембране, называемых «рецепторами смерти». При связывании лигандов они активируют каспазу-8, образуя «индуцирующий смерть сигнальный комплекс», содержащий «рецептор смерти», адаптеры TRADD (TNFR1-associated protein with death domain) или FADD (Fasassoccated protein with death domain) и профермент каспазы-8.
Митохондриям принадлежит центральная роль в осуществлении апоптоза у млекопитающих. Сигналы от рецепторов смерти или от поврежденных участков клетки сходятся на них, вызывая повышение проницаемости обеих мембран, снижение мембранного потенциала (??m) и высвобождение белков апоптоза - апоптоз-индуцирующего фактора (AIF), SMAC (second mitochondria derived activator of caspases) и некоторых прокаспаз - из межмембранного пространства.
Наряду со специфически апоптозными белками, в цитоплазму выходит цитохром c. Там он связывается с Apaf-1 (apoptotic protease activating factor-1) и формирует так называемый апоптосомный комплекс, инициирующий активацию каспазного каскада. С помощью Smac и Omi/HtrA2 (Omi stress regulated endopeptidase/high temperature requirement protein A2) цитохром с запускает Apaf-1 зависимую активацию каспазы-9. Каспаза-9 активирует каспазы-3 и -7 (рисунок); те в свою очередь расщепляют различные белки, приводя к появлению биохимических и морфологических признаков аоптоза.
3. Фазы апоптоза
Стадии апоптоза
Различают три физиологические фазы апоптоза:
1. Сигнальная (активация специализированных рецепторов).
Инициация апоптоза может происходить посредством внешних (внеклеточных) или внутриклеточных факторов. Например, в результате гипоксии, гипероксии, субнекротического поражения химическими или физическими агентами, перекрёстного связывания соответствующих рецепторов, нарушения сигналов клеточного цикла, удаления факторов роста и метаболизма и т.д. Несмотря на разнообразие инициирующих факторов, выделяются два основных пути передачи сигнала апоптоза: рецептор- зависимый (внешний) сигнальный путь с участием рецепторов гибели клетки и митохондриальный(собственный) путь.
Рецептор-зависимый сигнальный путь
Процесс апоптоза часто (например, у млекопитающих) начинается с взаимодействия специфических внеклеточных лигандов с рецепторами клеточной гибели, экспрессированными на поверхности клеточной мембраны. Рецепторы, воспринимающие сигнал апоптоза, относятся к суперсемейству TNF-рецепторов (англ. tumor necrosis factor receptor или кратко TNFR - «рецептор фактора некроза опухолей»). Наиболее изученными рецепторами смерти, для которых описана и определена роль в апоптозе, являются CD95 (также известный как Fas или APO-1) и TNFR1 (также называемый p55 или CD120a). К дополнительным относятся CARI, DR3 (англ. death receptor 3 - «рецептор смерти 3»), DR4 и DR5.
Все рецепторы смерти представляют собой трансмембранные белки, характеризующиеся наличием общей последовательности из 80 аминокислот в цитоплазматическом домене. Данная последовательность называется доменомсмерти (англ. death domain или кратко DD) и является необходимой для трансдукции сигнала апоптоза.Внеклеточные участки рецепторов смерти взаимодействуют с тримерами лигандов (CD95L, TNF, Apo3L, Apo2L и т.п.). Тримеры лигандов в результате взаимодействия тримеризуют рецепторы смерти (то есть «сшивают» 3 молекулы рецептора). Активированный таким образом рецептор взаимодействует с соответствующим внутриклеточным адаптером (или адаптерами). Для рецептора CD95 (Fas/APO-1) адаптером является FADD (от англ. Fas-associated DD-protein - «белок, взаимодействующий с доменом смерти Fas-рецептора»). Для рецепторов TNFR1 и DR3 адаптером является TRADD (от англ. TNFR1-associated DD-protein - «белок, взаимодействующий с доменом смерти TNFR1-рецептора»).
Адаптер, ассоциированный с рецептором смерти, вступает во взаимодействие с эффекторами - пока ещё неактивными предшественниками протеаз из семейства инициирующих каспаз - с прокаспазами. В результате цепочки взаимодействия «лиганд-рецептор-адаптер-эффектор» формируются агрегаты, в которых происходит активация каспаз. Данные агрегаты именуются апоптосомами, апоптозными шаперонами или сигнальными комплексами, индуцирующими смерть (от англ. DISC - death-inducing signaling complex - «сигнальный комплекс, индуцирующий смерть»). Примером апоптосомы может служить комплекс FasL-Fas-FADD-прокаспаза-8, в котором активируется каспаза-8.
Рецепторы смерти, адаптеры и эффекторы взаимодействуют между собой сходными по структуре доменами: DD, DED, CARD. DD (от англ. death domain - «домен смерти») участвует во взаимодействии рецептора Fas с адаптером FADD и во взаимодействии рецепторов TNFR1 или DR3 с адаптером TRADD. Посредством домена DED (от англ. death-effector domain - «домен эффектора смерти») осуществляется взаимодействие адаптера FADD с прокаспазами?8 и?10. Домен CARD (от англ. caspase activation and recruitment domain - «домен активации и рекрутирования каспазы») участвует во взаимодействии адаптера RAIDD с прокаспазой-2.
Посредством рецепторов смерти могут быть активированы три инициирующие каспазы: ?2; ?8 и?10. Активированные инициирующие каспазы далее участвуют в активации эффекторных каспаз.
Митохондриальный сигнальный путь
Большинство форм апоптоза у позвоночных реализуется по митохондриальному пути, а не через рецепторы клеточной гибели. Митохондриальный сигнальный путь апоптоза реализуется в результате выхода апоптогенных белков из межмембранного пространства митохондрий в цитоплазму клетки. Высвобождение апоптогенных белков, предположительно, может осуществляться двумя путями: за счёт разрыва митохондриальной мембраны или же путём открытия высокопроницаемых каналов на внешней мембране митохондрий.
Ключевым событием митохондриального пути апоптоза является повышение проницаемости наружной мембраны митохондрий (англ. Mitochondrial Outer Membrane Permeabilization, MOMP). Существенную роль в повышении MOMP играют апоптотические Bcl-2 белки - Bax и Bak. Они встраиваются в наружную мембрану митохондрий и олигомеризуются. При этом, вероятно, нарушается целостность внешней мембраны митохондрий, по неизвестному пока механизму. При повышении MOMP из межмембранного пространства митохондрий в цитозоль высвобождаются растворимые белки, участвующие в апоптозе: цитохром c - белок с молекулярной массой 15 кДа; прокаспазы?2, ?3 и?9; AIF (от англ. apoptosis inducing factor - «фактор индуцирующий апоптоз») - флавопротеин с молекулярной массой 57 кДа.
Разрыв внешней мембраны митохондрий объясняется увеличением объема митохондриального матрикса. Данный процесс связывают с раскрытием пор митохондриальной мембраны, приводящим к снижению мембранного потенциала и высокоамплитудному набуханию митохондрий вследствие осмотического дисбаланса. Поры диаметром 2,6-2,9 нм способны пропускать низкомолекулярные вещества массой до 1,5 кДа. Раскрытие пор стимулируют следующие факторы: неорганический фосфат; каспазы; SH-реагенты; истощение клеток восстановленным глутатионом; образование активных форм кислорода; разобщение окислительного фосфорилирования протонофорными соединениями; увеличение содержания Ca2+ в цитоплазме; воздействие церамида; истощение митохондриального пула АТФ и др.
Цитохром c в цитоплазме клетки участвует в формировании апоптосомывместе с белком APAF-1 (от англ. Apoptosis Protease Activating Factor-1 - «активирующий фактор апоптотической протеазы-1»). Предварительно, APAF-1 претерпевает конформационные изменения в результате реакции, протекающей с затратой энергии АТФ. Предполагается, что трансформированный APAF-1 приобретает способность связывать цитохром c . К тому же открывается доступ CARD-домена APAF-1 для прокаспазы-9. В итоге происходит олигомеризация 7 субъединиц трансформированного белка APAF-1 с участием цитохрома c и прокаспазы-9. Так образуется апоптосома, активирующая каспазу-9. Зрелая каспаза-9 связывает и активирует прокаспазу-3 с образованием эффекторной каспазы-3. Высвобождающийся из межмембранного пространства митохондрий флавопротеин AIF является эффектором апоптоза, действующим независимо от каспаз.
2. Эффекторная (т.е. формирование из разнородных эффекторных сигналов единого пути апоптоза, и запуск каскада сложных биохимических реакций).
В течение эффекторной фазы различные инициирующие пути конвертируются в один (или несколько) общий путь апоптоза. Как правило, происходит активация каскада белков-эффекторов и регулирующих их белков-модуляторов. Основными эффекторами апоптоза являются каспазы. В процессе активации они запускают каспазный каскад: сложно переплетённые цепочки взаимодействий инициирующих и эффекторных каспаз:
Помимо каспазсуществуют и другие эффекторы апоптоза. Например, флавопротеин AIF, высвобождающийся из межмембранного пространства митохондрий, действует по независимому от каспаз пути. Попадая в клеточное ядро, AIF вызывает конденсацию хроматина и активирует эндонуклеазы, которые участвуют в фрагментации ДНК. На основании экспериментальных данных установлено, что апоптоз, протекающий в присутствии AIF, не предотвращается ингибитором каспаз. В качестве эффекторов апоптоза также рассматриваются кальпаины - представители семейства цитозольных Ca2+-активируемых цистеиновых протеаз. Их роль в апоптозе пока слабо охарактеризована.
Деградационная (фаза экзекуции или деструкции).
Условно деградацию погибающей клетки можно разделить на три последовательных фазы: высвобождения, блеббинга и конденсации. Деградация большинства клеток начинается с высвобождения прикреплений внеклеточного матрикса и реорганизации фокальной адгезии. Внутри погибающей клетки деполимеризуются микротрубочки цитоскелета. Внутриклеточные актиновые микрофиламенты реорганизуются в связанные с мембраной периферийные (кортикальные) кольцевые пучки. В итоге клетка приобретает округлую форму. Следующая за высвобождением, стадия блеббинга, характеризуется сокращением периферийных актиновых колец. В результате сокращений клеточная мембрана образует вздутия, клетка как бы «кипит». Процесс блеббинга энергозависим и требует большого количества АТФ. Фаза блеббинга в нормальных условиях завершается примерно через час. В итоге клетка фрагментируется на маленькие апоптотические тела, либо целиком конденсируется, округляясь и уменьшаясь в размерах.
Роль белка р53
В нормальных клетках белок p53, как правило, находится в неактивной, латентной форме. Активация p53 происходит в ответ на повреждения ДНК, вызванные ультрафиолетовым или гамма-излучением, гиперэкспрессией онкогенов, вирусной инфекцией, оксидативным стрессом, гипо- и гипертермией и др.Активированный p53 координирует процесс репарации ДНК, а также регулирует транскрипцию ряда генов-активаторов апоптоза в случае необратимых повреждений ДНК или нарушений регуляции клеточного цикла. К тому же имеются указания на то, что p53 принимает участие в запуске апоптоза путём стимуляции рецепторов смерти, путём взаимодействия с промотором апоптоза - Bax, путём активации p53-зависимого модулятора апоптоза PUMA (англ. p53 upregulated modulator of apoptosis), который блокирует действие Bcl-2.Повышение уровня p53 в ответ на повреждения ДНК вызывает апоптоз, например, в клетках кожи, в тимоцитах, в клетках кишечного эпителия.
4. Роль апоптоза в процессах старения
Предположение о роли апоптотической гибели в процессах старения было высказано ещё в 1982 году. Со временем выяснилось, что различные виды возрастзависимой дисрегуляции апоптоза присущи многим типам клеток. Например, в стареющем организме повышается чувствительность к индукции апоптоза для следующих типов клеток: гепатоцитов, кардиомиоцитов, макрофагов, мегакариоцитов, нейронов, ооцитов, спленоцитов, T-лимфоцитов, хондроцитов, эндотелиоцитов. Но в то же время, для фибробластовнаблюдается обратная тенденция к снижению чувствительности к апоптозу, а для кератиноцитов данная чувствительность не изменяется.
К настоящему времени имеются, как минимум, две точки зрения на связь апоптоза с процессами старения. Согласно одной из версий нормальные (гомеостатические) апоптотические процессы могут участвовать в развитии возрастных патологий и фенотипов старения. К примеру, с апоптотической гибелью постмитотических клеток (кардиомиоцитов, нейронов) связаны процессы старения сердечной мышцы или развитие возрастных нейродегенеративных патологий. Старение иммунной системы также связывают с программируемой гибелью различных типов лейкоцитов в результате возрастных изменений в соотношении про- и антиапоптозных факторов. Возрастная хрящевая дегенерация кореллирует с повышением уровня апоптоза хондроцитов в суставных хрящах у мышей и крыс, а также в межпозвоночных дисках при старении у человека. Согласно другой точке зрения накопление стареющих клеток в тканях объясняется возрастной резистентностью к апоптозу. В качестве примера, рассматривается устойчивость стареющих фибробластов к апоптозу, приводящая в итоге к преждевременному старению нормальных фибробластов и, возможно, к нарушению функций соединительной ткани.
5. Патология, связанная с усилением апоптоза
Одной из групп заболеваний, связанных с усилением апоптоза, являются патологии системы крови. Чаще всего патологические процессы развиваются в результате гибели посредством апоптоза костномозговых клеток-предшественников. Причиной их гибели является недостаточность факторов выживания. Данный тип патологии приводит к развитию апластической анемии; анемии при дефиците железа, фолатов, витамина B12; талассемии; тромбоцитопении; лимфопении; нейтропении; панцитопении. Повышенная готовность к развитию апоптоза Т-лимфоцитов обнаружена при мультицентрической болезни Кастелмана.
Прогрессия некоторых инфекционных заболеваний может быть связана не только с подавлением, но и наоборот, с усилением апоптоза. Индукторами программируемой клеточной гибели при этом служат бактериальные эндо- и экзотоксины. Массовый апоптоз развивается при сепсисе. Гибель лимфоцитов путём апоптоза находится в положительной корреляции с быстрой прогрессией СПИДа.
Отдельную группу патологии составляют заболевания нервной системы, обусловленные атрофией определённых участков нервной ткани в результате апоптоза. Примерами таких заболеваний могут служить боковой амиотрофический склероз, болезнь Альцгеймера, спинальная мышечная атрофия и др.
Апоптоз является преобладающей формой гибели миоцитов в ранний период развития инфаркта. На основе экспериментальных данных было выявлено, что программируемая гибель кардиомиоцитов может быть обусловлена гипоксией, ишемией, перегрузкой клетки кальцием, воспалением, токсинами. В процессе токсического (в том числе и алкогольного) гепатита основная роль также отводится апоптозу.
Ряд патологических процессов, обусловленных усилением апоптоза, индуцируется внешними апоптогенными факторами. Апоптоз прогрессирует под воздействием ионизирующей радиации.При этом преимущественно гибнут лимфоидные клетки и развивается иммунная недостаточность. Аналогичный эффект дают многие химиотерапевтические препараты, используемые при лечении опухолей, а также гормоны, применяемые при лечении различных заболеваний.
6. Другие формы ПКС (программируемой клеточной смерти)
·Аутофагию
·Некроз
Термином « Аутофагия» (Autophagy, от греческих слов: «Авто», означающими само- и «phagein означающее «поглощать») обозначают поглощение и переваривание в лизосомах «состарившихся» или поврежденных молекул или органелл собственной клетки. Аутофагия - необходимая часть обновления молекул и органелл клетки (вместе с образованием новых молекул и органелл). Внутриклеточный материал сначала включается в пузырьки, образуемые мембранами эндоплазматического ретикулума, а затем эти пузырьки сливаются с лизосомами.В каждой клетке печени за сутки разрушается около 100 митохондрий С/20 часть всех митохондрий).
При воспалительных процессах мембранные структуры клеток повреждаются, в том числе и мембраны лизосом. Лизосомные ферменты освобождаются и переваривают клетку; этот процесс может способствовать образованию язв. Разрушение соединительнотканного матрикса при таких заболеваниях, как ревматоидный артрит, миодистрофия, инфаркт миокарда, связано с освобождением лизосомальных ферментов. С другой стороны, гетерофагия и аутофагия участвуют в заживлении ран и воспалительных повреждений тканей, удаляя погибшие клетки или фрагменты клеток. Одна из важных функций эндоцитоза и лизосом связана с регуляцией количества рецепторов, экспонированных на поверхности клетки.
Некроз (от греч. ?????? - мёртвый), или омертве?ние - это патологический процесс, выражающийся в местной гибели ткани в живом организме в результате какого-либо экзо- или эндогенного её повреждения.
Некроз проявляется в набухании, денатурации и коагуляции цитоплазматических белков, разрушении клеточных органелл и, наконец, всей клетки. Наиболее частыми причинами некротического повреждения ткани являются: прекращение кровоснабжения (что может приводить к инфаркту, гангрене) и воздействие патогенными продуктами бактерий или вирусов (токсины, белки, вызывающие реакции гиперчувствительности, и др.)
7. Отличия между некрозом и апоптозом
Отличия апоптоза от некроза связаны с различиями в их встречаемости, биохимическими, генетическими, морфологическими и клиническими реакциями. Главным отличием апоптоза от некроза является то, что апоптоз распространяется исключительно на отдельные клетки или их совокупности, в то время как некроз может уничтожить территорию начиная от части клетки вплоть до органа.
Апоптоз происходит в клетках при определённых генетических событиях, которые во многом ещё недостаточно проанализированы. При апоптозе увеличивается экспрессия генов, ответственных запролиферацию и дифференцировку клеток из совокупности клеточных онкогенов (c-fos, c-myc, c-bcl-2) и антионкогенов (p53). Активация клеточных онкогенов должна привести к увеличению пролиферации клеток, однако при параллельной активации антионкогена р53 происходит апоптоз. Описанные взаимоотношения между генами показывают возможность регуляции процессов пролиферации и гибели клеток, построенной в генетическом аппарате клеток. В связи с тем, что взаимодействия между генами происходят с помощью их белковых соединений, в момент апоптоза в клетке увеличивается белковый синтез. Ингибирование этого процесса может предотвращать апоптоз.
Морфологические отличия апоптоза от некроза.Эти отличия касаются в основном ультраструктурных перестроек. Но это не значит, что апоптоз невозможно наблюдать на светооптическом уровне. При световой микроскопии клетки в состоянии апоптоза и их фрагменты (апоптозные тельца) отличаются небольшими размерами, сравнимыми с размерами лимфоцитов, с высоким ядерно-цитоплазматическим соотношением, округлыми контурами и конденсированными хроматином и цитоплазмой. Существенным отличием является также отсутствие воспалительной реакции на апоптоз.
Ультраструктурные отличия апоптоза от некроза.Существуют следующие ультраструктурные отличия. - Потеря специализированных структур клеточной поверхности - микроворсинок, межклеточных контактов. Клетка приобретает округлую форму и теряет связь с соседними клетками. В отличие от некроза речь идет всегда об изменениях в отдельных клетках.
- Размеры клеток уменьшаются в связи с конденсацией цитоплазматических органелл; изменяется также и форма клетки. Часто клетка расщепляется на несколько апоптозных телец, каждое из которых имеет свой фрагмент ядра, ограниченный двухконтурной ядерной мембраной, и индивидуальный набор орга-нелл.
В отличие от некроза при апоптозе имеется сохранность и интегративность органелл. Митохондрии не набухают, в них не происходит разрыва внутренней мембраны. Характерными для апоптоза являются такие ультраструктурные изменения, как агрегация рибосом в полукристаллоидные структуры, появление пучков микрофиламентов под цитолеммой, расположенных параллельно мембране. Почти всегда наблюдается кратковременная дилатация агранулярной эндоплазматической сети с формированием пузырей, наполненных жидкостью, которые выводятся из клетки. При изучении в сканирующем электронном микроскопе поверхность клетки приобретает кратерообразные выпячивания. - Наиболее яркое отличие апоптоза от некроза связано с изменениями ядерного хроматина, который конденсируется под кари-олеммой в виде полусфер и глыбок. В ядре обнаруживаются ос-миофильные тельца, сформированные транскрипционными комплексами, поступающими из ядрышек. Ядро меняет свою форму, становится изрезанным, фрагментирустся, ядерные поры концентрируются только в участках, где отсутствует маргинации хроматина.
Клетка в состоянии апоптоза становится объектом фагоцито-за для соседних паренхиматозных и стромальных клеток в прежде всего для макрофагов. Фагоцитоз происходит настолько быстро, что в условиях in vivo апоптозные клетки сохраняются лини, и течение нескольких минут, что затрудняет их наблюдение.
Заключение
В генетическом аппарате каждой клетки многоклеточного организма имеется специальная программа, которая при определенных обстоятельствах может привести клетку к гибели. При нормальном развитии эта программа направлена на удаление избыточно образовавшихся клеток - «безработных», а также клеток - «пенсионеров», переставших заниматься общественно полезным трудом. Другая важная функция клеточной гибели - удаление клеток - «инвалидов» и клеток «диссидентов» с серьезными нарушениями структуры или функции генетического аппарата. В частности, апоптоз - один из основных механизмов самопрофилактики онкологических заболеваний
Система программируемой клеточной смерти - существенный фактор иммунитета, поскольку гибель зараженной клетки может предотвратить распространение инфекции по организму. Другое дело, что некоторые инфекционные агенты выработали специальные меры для предотвращения преждевременной гибели зараженных клеток. Нарушения системы программируемой гибели клетки - причина серьезной патологии. Ослабление способности к апоптозу может вести к развитию злокачественных опухолей. Некоторые заболевания, в частности дегенеративные повреждения нервной системы, - результат избыточного апоптоза.
Воздействие на программу клеточной гибели - перспективное направление лекарственного лечения. Так, одна из важных задач противораковой терапии - стимуляция апоптозной системы. В других случаях задача врача, наоборот, предотвратить вредное для организма клеточное самоубийство. Таким образом, какие-то компоненты каждой клетки по праву могли бы нести микроскопическое изображение черепа со скрещенными костями. Однако следует признать, что наличие такого смертельного механизма - обстоятельство не только необходимое, но в конечном итоге крайне благоприятное. Без системы программируемой клеточной гибели мы с вами не могли бы появиться на свет такими, какими мы рождаемся. И поддержание порядка в наших организмах в течение дальнейшей жизни в значительной степени обеспечивается именно способностью наших клеток к программируемой смерти.
Список использованной литературы
1.А.В. Гордеева, Ю.А. Лабас, Р.А Звягильская: «АПОПТОЗ ОДНОКЛЕТОЧНЫХ ОРГАНИЗМОВ: МЕХАНИЗМЫ И ЭВОЛЮЦИЯ» Обзор. Институт биохимии им. А.Н. Баха РАН, Москва, 2004 год.
2.Анисимов В.Н.: «Молекулярные и физиологические механизмы старения» в 2 Т., СПб, 2008, 2-ое издание дополненное и переработанное.
.В.И. Агол: «Генетически запрограммированная смерть клетки», Московский Государственный университет им. М.В. Ломоносова, Соровский образовательный журнал №6, 2006 год.
.Бра М. Митохондрии в программированной гибели клетки: различные механизмы гибели / М. Бра, Б. Квинан, С.А. Сузин // Биохимия. 2005. - Т.70. - №2.
.Лушников Е.Ф. Гибель клетки (апоптоз) / Е.Ф. Лушников, А.Ю. Абросимов. М.: Медицина, 2001. - 192 с.
.#"justify">.#"justify">.#"justify">9.#"justify">10.#"justify">.http://tsitologiya.cytspb.rssi.ru/49_5/shirokova.pdf
Репетиторство
Нужна помощь по изучению какой-либы темы?
Наши специалисты проконсультируют или окажут репетиторские услуги по интересующей вас тематике.
Отправь заявку
с указанием темы прямо сейчас, чтобы узнать о возможности получения консультации.
Термин"апоптоз", предложенный в 1972 г. английскими учеными J.F.R. Кеrr, А.Н. Wyllie и A.R. Currie, состоит из двух греческих слов и означает в буквальном смысле "отделение лепестков от цветов", а применимо к клетке - особый тип смерти путем разделения ее на части (" апоптозные тельца "), которые впоследствии фагоцитируются соседними клетками разного типа.
Термин "программированная клеточная смерть" отражает функциональное назначение этого процесса, представляющего естественную часть жизни многоклеточного организма, связанного с метаморфозом и развитием [ Hedgecock E.M., Salston J.E. 1983 , Oppenheim R.W. 1991 ].
В генетическом аппарате многоклеточных организмов - животных, растений и грибов заложена программа гибели клеток. Это специальная программа, которая при определенных обстоятельствах может привести клетку к гибели. При нормальном развитии эта программа направлена на удаление избыточно образовавшихся клеток -"безработных", а также клеток -"пенсионеров", переставших заниматься общественно полезным трудом. Другая важная функция клеточной гибели - удаление клеток -"инвалидов" и клеток- "диссидентов" с серьезными нарушениями структуры или функции генетического аппарата. В частности, апоптоз - один из основных механизмов самопрофилактики онкологических заболеваний [ Thompson ea 1995 ].
Апоптоз играет главную роль как в развитии так и в гомеостазе [ Steller ea 1997 ]. Клетки умирают от апоптоза в развивающемся эмбрионе в ходе морфогенеза или синантогенеза и во взрослых животных в ходе обновления тканей. Система программируемой клеточной смерти - существенный фактор иммунитета , поскольку гибель зараженной клетки может предотвратить распространение инфекции по организму. Формообразовательные процессы в онтогенезе, позитивная и негативная селекция Т- и В-лимфоцитов у животных, гипер-чувствительный ответ растений на вторжение патогена, осенний листопад - лишь несколько примеров программируемой клеточной смерти (апоптоза).
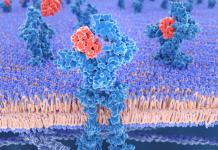
Определенные клетки организма обладают уникальными сенсорами, называемыми рецепторами смерти , расположенными на поверхности клеток. Рецепторы смерти детектируют присутствие межклеточных сигналов смерти и в ответ на это быстро запускают внутриклеточный механизм апоптоза.
Поскольку физиологическая роль апоптоза очень существенна, нарушения этого процесса могут быть весьма вредными. Так, несвоевременный апоптоз определенных мозговых нейронов оказывает влияние на образование нарушений, таких как болезни Альтцгеймера и Паркинсона , в то время как неспособность делящихся клеток перейти к апоптозу после случившихся существенных нарушений ДНК способствует развитию рака.
Другим механизмом, направленным на подавление апоптоза, является активация транскрипционного фактора NF-кВ . Известен целый ряд антиапоптозных белков, кодируемых генами, экспрессия которых возрастает под действием NF-кВ, что приводит к предотвращению гибели клетки [ O"Connor et al., 2000 ]. Таким образом, регуляция апоптоза представляет собой пример сбалансированного механизма с многократным дублированием противовесов, призванным обеспечить надежный контроль за реализацией столь важной для клетки программы и в то же время делающим ее очень зависимой от внешних и внутренних воздействий.
В развитии апоптоза выделяют 3 морфологичеси различимых стадии: сигнальную (индукторную), эффекторную и деградации (деструкции). Индукторами апоптоза могут быть как внешние (внеклеточные) факторы, так и внутриклеточные сигналы. Сигнал воспринимается рецептором и далее последовательно передается молекулам-посредникам (мессенджерам) различного порядка и достигает ядра, где происходит включение программы клеточного "самоубийства" путем активации летальных и/или репрессии антилетальных генов. В ядре регистрируются первые морфологические признаки апоптоза - конденсация хроматина с формированием его осмиофильных скоплений, прилежащих к ядерной мембране. Позже появляются инвагинации (вдавления) ядерной мембраны, и происходит фрагментация ядра. В основе деградации хроматина лежит ферментативное расщепление ДНК [ Arends ea 1990 , Wyllie ea 1980 ]. Сначала образуются фрагменты, включающие 700, 200-250, 50-70 тыс. пар оснований, затем - фрагменты, содержащие 30-50 тыс. пар оснований. После реализации этого этапа процесс становится необратимым. Затем наступает межнуклеосомная дезинтеграция ДНК, т.е. разрывы нитей ДНК, находящихся между нуклеосомами. При этом образуются фрагменты, кратные по величине 180-190 пар оснований, что соответствует протяженности нити ДНК в пределах одной нуклеосомы. Отделившиеся фрагменты ядра, ограниченные мембраной, называют апоптотическими тельцами. В цитоплазме происходит расширение эндоплазматического ретикулума, конденсация и сморщивание гранул. Важнейшим признаком апоптоза является снижение трансмембранного потенциала митохондрий и выход в цитоплазму различных апоптогенных факторов (цитохрома с; прокаспаз 2, 3, 9; апоптоз-индуцирующего фактора). Именно нарушению барьерной функции митохондриальных мембран отводят ключевую роль в развитии многих типов апоптоза. Клеточная мембрана утрачивает ворсинчатость и образует пузыревидные вздутия. Клетки округляются и отделяются от субстрата. На поверхности клетки экспрессируются различные молекулы, распознаваемые фагоцитами - фосфосерин, тромбоспондин, десиалированные мембранные гликоконъюгаты, в результате чего происходит поглощение тела клетки другими клетками и его деградация в окружении лизосом фагоцитарных клеток [
Существует множество определений понятия "апоптоз".
- явление программируемой клеточной смерти, сопровождаемой набором характерных цитологических признаков (маркеров апоптоза) и молекулярных процессов, имеющих различия у одноклеточных и многоклеточных организмов (т.е. изменений в строении и функционировании клетки, характерных для апоптоза).
- форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации (уплотнении) и фрагментации хроматина, уплотнении наружной и цитоплазматической мембран без выхода содержимого клетки в окружающую среду.
Суть апоптоза заключается в том, что это программируемая клеточная гибель, т.е. существуют определенные механизмы, в результате реализации которых клетка сама завершает свое существование.
В многоклеточном организме апоптозом гибнут клетки в процессе эмбриогенеза, Т-клетки в процессе дифференцировки в тимусе, клетки, зараженные вирусами, измененные клетки (при недостаточной интенсивности апоптотических процессов развиваются онкологические заболевания) и мн. др.Основное биологическое назначение апоптоза состоит в том, чтобы в процессе эмбрионального морфонегеза создавать органы и ткани с эволюционно закрепленными конфигурациями и размерами и затем поддерживать эти параметры с допустимыми допусками в течение жизни. Важнейшим проявлением этой функции апоптоза после окончания развития человека и других млекопитающих является его участие в процессе физиологической регенерации (обновления) клеток разных тканей и органов и поддержании клеточного гомеостаза. Регенерации в разной степени выраженности на протяжении всей жизни подвержены практически все клетки нашего организма. Особенно интенсивно клеточное обновление протекает в клетках эпителия, соприкасающихся с внешней средой, кожи, желудочно-кишечного тракта, мочеполовой и легочной систем, а также в клетках крови, иммунной системы.
Важна роль и в процессах отторжения чужеродных органов и тканей при их трансплантации.
Другой важнейшей функцией апоптоза является контроль за внутренней средой клетки, в том числе клеточного ядра с его содержимым. Правда, сейчас показано, что апоптоз может протекать и в клетках, лишенных ядра. При возникновении в клетке нарушений, превышающие допустимые пределы, клетка подвергается самоуничтожению. Апоптоз возникает при действии различных повреждающих факторов, которые способны вызвать некроз, но действующих в небольших дозах, например, при действии высокой температуры, ионизирующего излучения, противоопухолевых препаратов.
Апоптоз принимает активное участие в ряде физиологических и патологических процессов. Например, при гормон-зависимой инволюции органов у взрослых, в частности, отторжение эндометрия во время менструального цикла, атрезии (заращении) фолликулов в яичниках в менопаузе и регрессии (обратном развитии) молочной железы после прекращения лактации.
Велика роль апоптоза и при патологической атрофии гормон-зависимых органов, например, атрофии предстательной железы после кастрации и истощении лимфоцитов в тимусе при терапии глюкокортикоидами. Или патологической атрофии паренхиматозных органов после обтурации (закупорки) выводных протоков, что наблюдается в поджелудочной и слюнных железах, почках. Гибель клеток в процессе атрофии наблюдается и в коре надпочечников при воздействии глюкокортикоидов или при атрофии эндокрин-зависимых тканей.
Во многих случаях острого или хронического ишемического либо токсического воздействия гибель клеток происходит через апоптоз. Такая картина наблюдается при инсульте, инфаркте не только миокарда, но и в почках, при диабете, отдельных формах нефрита, нейродегенеративных заболеваниях, таких как болезнь Альцгеймера и Паркинсона. В патогенезе токсических повреждений печени, поджелудочной железы и почек активация апоптоза также имеет важное значение.
Формы клеточной гибели, их различия

Существует две формы гибели клетки - некроз и апоптоз.
Некроз
- это патологический процесс, выражающийся в местной гибели ткани в живом организме в результате какого-либо экзо- (внешнего) или эндогенного (внутреннего) ее повреждения. Некроз проявляется в набухании, денатурации и коагуляции (слипании) цитоплазматических белков, разрушении клеточных органелл и, наконец, всей клетки.
Главное отличие некроза и апоптоза состоит в том, что апоптоз - это программируемая гибель клетки, а некроз - это патологический процесс, запускающийся в ответ на какое-либо повреждающее воздействие (инфекция, химическое воздействие, облучение, недостаточное кровоснабжение и т.д.).
В процессе апоптоза в клетке задействованы сложные молекулярные каскады, в результате реализации которых происходит сморщивание цитоплазматической мембраны, уменьшение объёма клетки, разрывы нитей ядерной ДНК, конденсация хроматина по периферии ядра, последующий распад ядра на части, фрагментация клеток на везикулы (пузырьки) с внутриклеточным содержимым - апоптотические тельца, которые захватываются соседними клетками, могут и фагоцитами, как в случае некроза. Выброса клеточного содержимого не происходит, воспаления не возникает.

При некрозе, наоборот, происходит выход лизосомальных ферментов из лизосом, которые и переваривают содержимое клетки, клетка набухает и лопается. Содержимое клетки выбрасывается во внеклеточную среду, где поглощается фагоцитами, развивается воспаление.
Апоптоз- это физиологический процесс, некроз- патологический.
Существуют и другие формы программируемой гибели, например, аутофагия
. Процесс аутофагии заключается в том, что органеллы соединяются с лизосомами, где перевариваются лизосомальными ферментами. Затем остатки клетки поглощают макрофаги .
а) - Кинетическая модель баланса апоптоза и аутофагии. Одно из летальных воздействий активирует в клетке программу и клетка "решает умереть". Если достаточно апоптотических эффекторов (молекул, задействованных в процессе апоптоза), то апоптоз является единственным ответом большинства клеток на летальное воздействие. Подавление апоптотических эффекторов запускает альтернативный путь- аутофагию.
b) - Ингибиторная модель. Когда летальное воздействие активирует BAX/BAK- зависимый митохондриальный внемембранный путь (BAX/BAK-dependent mitochondrial outer-membrane permeabilization pathway) запускается апоптоз. BAX/BAK, так же как и каспазы, является активным ингибитором BCL2/BCL-XL, облегчающего аутофагию. Активный апоптоз подавляет аутофагию.
Механизмы апоптоза
 Механизмы апоптоза сложны и многообразны, представляют собой сложнейший молекулярный каскад, изучением которого занимаются многие и многие лаборатории по всему миру. Несомненная важность этих исследований в аспекте онкологии и геронтологии доказана успехами терапии онкологических заболеваний индукторами апоптоза раковых клеток.
Механизмы апоптоза сложны и многообразны, представляют собой сложнейший молекулярный каскад, изучением которого занимаются многие и многие лаборатории по всему миру. Несомненная важность этих исследований в аспекте онкологии и геронтологии доказана успехами терапии онкологических заболеваний индукторами апоптоза раковых клеток.
Так каковы же механизмы.
Поговорим об этом по-подробнее
Первый этап - смертельный приказ
 С чего же начинается этот сложный процесс? С того, что клетка получает "приказ умереть", ее гибель необходима для дальнейшей жизнедеятельности организма. Это происходит с помощью сигналов из внеклеточной среды, которые клетка воспринимает с помощью своего рецепторного аппарата. Иногда сигналом для начала апоптоза может быть и отсутствие необходимого сигнала.
С чего же начинается этот сложный процесс? С того, что клетка получает "приказ умереть", ее гибель необходима для дальнейшей жизнедеятельности организма. Это происходит с помощью сигналов из внеклеточной среды, которые клетка воспринимает с помощью своего рецепторного аппарата. Иногда сигналом для начала апоптоза может быть и отсутствие необходимого сигнала.
В результате контакта сигнальных молекул с наружной частью белка-рецептора этот рецептор претерпевает структурные изменения. Структурная перестройка захватывает и внутриклеточную часть молекулы рецептора. Она может либо обладать определенной ферментативной активностью сама, либо быть тесно связана с некоторыми клеточными ферментами. Изменение активности рецепторной молекулы приводит к активации фермента.
Часто речь идет об изменении концентрации ионов кальция, а также некоторых относительно мелких фосфорсодержащих органических соединений, относящихся к классу нуклеотидов.
Активные соединения появляются и в результате гидролиза определенных липидов клеточной мембраны. В свою очередь, все это ведет к присоединению или отсоединению остатков фосфата от молекул белковых регуляторов (фосфорилирование), способных влиять на генетический аппарат клетки.
Фосфорилирование и дефосфорилирование (отщепление остатка фосфорной кислоты), а также некоторые другие биохимические модификации меняют активность этих регуляторов.
Рецепторы, воспринимающие "летальный сигнал"
 Известны два структурно гомологичных рецептора
TNF
, р55 и р75 (TNF-RI и TNF-RII , соответственно), относящиеся к трансмембранным белкам I типа. Кроме этого задействованы "рецепторы смерти" CD95
. Рецепторы CD95 и рецепторы TNF принадлежат к растущему суперсемейству рецепторов, имеющих гомологию в экстраклеточных доменах. Семейство включает в себя также рецептор фактора роста нервов, В-клеточный антиген CD40 , маркер активации Т-лимфоцитов CD27 и некоторые гомологичные белки млекопитающих и вирусов.
Известны два структурно гомологичных рецептора
TNF
, р55 и р75 (TNF-RI и TNF-RII , соответственно), относящиеся к трансмембранным белкам I типа. Кроме этого задействованы "рецепторы смерти" CD95
. Рецепторы CD95 и рецепторы TNF принадлежат к растущему суперсемейству рецепторов, имеющих гомологию в экстраклеточных доменах. Семейство включает в себя также рецептор фактора роста нервов, В-клеточный антиген CD40 , маркер активации Т-лимфоцитов CD27 и некоторые гомологичные белки млекопитающих и вирусов.
CD95 и TNF-R1 имеют дополнительную гомологичную последовательность во внутриклеточной части молекул. Этот трансдукции цитотоксического (повреждающего клетку) сигнала. Цитоплазматический С-конец CD95 содержит также "домен спасения" , удаление которого усиливает цитотоксическую активность рецептора.
TNF и лиганд CD95 (CD95-L) являются трансмембранными белками второго типа с внеклеточным С-концевым, внутриклеточным N-концевым и одним трансмембранным элементами, но они могут функционировать и в растворимой, "слущенной" с мембраны форме. И CD95-L, и TNF связываются с соответствующим рецепторами в виде тримера, "сшивают" 3 молекулы рецептора, что активирует его для передачи проапоптотического сигнала.
Интенсивные исследования сигнальных механизмов апоптоза, индуцированного антителами к CD95/CD95-L и TNF, привели к значительному прогрессу в двух направлениях - идентификация белков, взаимодействующих с CD95 и TNF-R1, и выяснение участия в процессе вторичного мессенджера церамида.
"Домен смерти" TNF-R1 взаимодействует также с серин/треониновой протеинкиназой и фосфорилируется этим ферментом. 30 С-концевых аминокислотных остатков ингибируют связывание рецептора с протеинкиназой. Роль этих событий в передаче цитотоксического сигнала неясна. Недавно описана тирозиновая фосфатаза, FAP-1 , взаимодействующая с 15 С-концевыми аминокислотами CD95, "доменом спасения". Гиперэкспрессия FAP-1 подавляет апоптоз, опосредованный CD95.
Описанные белки участвуют, по-видимому, в начальных этапах передачи сигнала. Другая группа данных свидетельствует о том, что и CD95-L или антитела к CD95, и TNF активируют сфингомиелиновый путь передачи.
Поздние этапы клеточной гибели, индуцированной через CD95 и TNF-R1, таковы же, как при классическом апоптозе. Гибель клеток может быть предотвращена crmA , что указывает на участие ICE-подобных протеаз. Bcl-2 подавляет апоптоз, индуцированный через CD95 и TNF-R1, по крайней мере на некоторых клеточных линиях.
Участие FAS (CD95)

Этот путь передачи летального сигнала схематически можно изобразить следующим образом: индукторы - рецепторы - адаптеры -каспазы первого эшелона -регуляторы -каспазы второго эшелона. Так, рецептор, обозначаемый Fas, взаимодействуя с соответствующим лигандом (лигандом FasL), трансмембранным белком Т-киллера, активируется и запускает программу смерти клетки, инфицированной вирусом. Тем же путем при взаимодействии с лигандом FasL на поверхности Тh1-лимфоцитов или с антителом к Fas-рецептору погибают ставшие ненужными выздоровевшему организму В-лимфоциты, продуценты антител, несущие Fas-рецептор. FasL– лиганд, относящийся к многочисленному семейству фактора некроза опухолей TNF. Это семейство гомотримерных лигандов (т.е. биологически активных веществ (белков), состоящих из 3 одинаковых доменов (частей), кроме FasL и TNFa , включает TNFb (лимфотоксин).
Fas – член семейства рецепторов TNF. Как говорилось выше, все они представлены трансмембранными белками, которые внеклеточными участками взаимодействуют с тримерами лигандов-индукторов. Взаимодействие рецептора и лиганда приводит к образованию кластеров рецепторных молекул и связыванию их внутриклеточных участков с адаптерами. Адаптер, связавшись с рецептором, вступает во взаимодействие с эффекторами, пока еще неактивными предшественниками протеаз из семейства каспаз первого эшелона (инициирующих каспаз).
Взаимодействие адаптера с рецептором и эффектором осуществляется через гомофильные белок-белковые взаимодействия небольших доменов: DD (death domain – домен смерти), DED (death-effector domain – домен эффектора смерти), CARD (– домен активации и рекрутирования каспазы). Все они имеют сходную структуру, содержат по шесть a-спиральных участков. Домены DD(домен смерти) участвуют во взаимодействии рецептора Fas c адаптером FADD (Fas-associated DD-protein). Домены DED участвуют во взаимодействии адаптера FADD с прокаспазами 8 и 10.
Наиболее подробно охарактеризована прокаспаза-8, рекрутируемая рецептором Fas через адаптeр FADD. Образуются агрегаты FasL – Fas – FADD – прокаспаза-8. Подобные агрегаты, в которых происходит активация каспаз, названы апоптосомами
, апоптозными
шаперонами
, или сигнальными комплексами, индуцирующими смерть
.
Прокаспазы обладают незначительной протеолитической активностью, составляющей 1–2% активности зрелой каспазы. Будучи в мономерной форме, прокаспазы, концентрация которых в клетке ничтожна, находятся в латентном состоянии. Предполагается, что пространственное сближение молекул прокaспаз при их агрегации ведет к образованию активных каспаз через механизм протеолитического само- и перекрестного расщепления (ауто- или транс-процессинга)]. В результате от прокаспазы (молекулярная масса 30–50 кДа) отделяется регуляторный N-концевой домен (продомен), а оставшаяся часть молекулы разделяется на большую (~20 кДа) и малую (~10 кДа) субъединицы (рис. 3). Затем происходит ассоциация большой и малой субъединиц. Два гетеродимера образуют тетрамер с двумя каталитическими участками, действующими независимо друг от друга. Таким образом прокаспаза-8 активируется и высвобождается в цитоплазму в виде каспазы-8. Существуют другие пути активации каспазы-8 – с участием рецепторов TNFR1 и DR3.
На этапе активации каспаз первого эшелона жизнь клетки еще можно сохранить. Существуют регуляторы, которые блокируют или, напротив, усиливают разрушительное действие каспаз первого эшелона. К ним относятся белки Bcl-2 (ингибиторы апоптоза: A1, Bcl-2, Bcl-W, Bcl-XL, Brag-1, Mcl-1 и NR13) и Bax (промоторы апоптоза: Bad, Bak, Bax, Bcl-XS, Bid, Bik, Bim, Hrk, Mtd). Эти белки эволюционно консервативны: гомолог Bcl-2 обнаружен даже у губок, у которых апоптоз необходим для морфогенеза.
Каспаза-8 активирует каспазу второго эшелона (эффекторную каспазу): путем протеолиза из прокаспазы-3 образуется каспаза-3, после чего процесс, запущенный программой смерти, оказывается необратимым.
Каспаза-3 способна в дальнейшем к самостоятельной активации (автокатализу или автопроцессингу), активирует ряд других протеаз семейства каспаз, активирует фактор фрагментации ДНК, ведет к необратимому распаду ДНК на нуклеосомальные фрагменты. Так запускается каскад протеолитических ферментов,осуществляющих апоптоз.
Каспазы
Каспазы-семейство эволюционно консервативных сериновых протеаз, которые специфически расщепляют белки после остатков аспарагиновой кислоты.
На основе структурной гомологии каспазы подразделяются на подсемейства
- каспазы-1 (каспазы 1, 4, 5),
- каспазы-2 (каспаза-2) и
- каспазы-3 (каспазы 3, 6–10) .
Цистеиновые протеазы, по-видимому, участвуют также в программированной клеточной гибели у растений. Однако апоптоз возможен и без участия каспаз: сверхсинтез белков-промоторов апоптоза BAX и BAK индуцирует гибель в присутствии ингибиторов каспаз.
В результате действия каспаз происходит:
1. Активация прокаспаз с образованием каспаз;
2. Расщепление антиапоптозных белков семейства Bcl-2. Подвергается протеолизу ингибитор ДНКазы, ответственный за фрагментацию ДНК. В нормальных клетках апоптозная ДНКаза CAD (caspase-activated DNase) образует неактивный комплекс с ингибитором CAD, обозначаемым ICAD или. При апоптозе ингибитор ICAD с участием каспаз 3 или 7 инактивируется, и свободная CAD, вызывая межнуклеосомальные разрывы хроматина, ведет к образованию фрагментов ДНК с молекулярной массой, кратной молекулярной массе ДНК в нуклеосомных частицах – 180-200 пар нуклеотидов.
Апоптоз возможен и без фрагментации ДНК. Обнаружен ядерный белок Acinus (apoptotic chromatin condensation inducer in the nucleus), из которого при комбинированном действии каспазы-3 (протеолиз при Asp 1093) и неидентифицированной протеазы (протеолиз при Ser 987) образуется фрагмент Ser 987 – Asp 1093. Этот фрагмент в присутствии дополнительных неядерных факторов вызывает апоптотическую конденсацию хроматина и фрагментацию ядра (кариорексис) без фрагментации ДНК;
3. Гидролиз белков ламинов, армирующих (укрепляющих) ядерную мембрану. Это ведет к конденсации хроматина;
4. Разрушение белков, участвующих в регуляции цитоскелета;
5. Инактивация и нарушение регуляции белков, участвующих в репарации ДНК, сплайсинге мРНК, репликации ДНК.
Мишенью каспаз является поли(ADP-рибозо)полимераза (PARP). Этот фермент участвует в репарации ДНК, катализируя поли(ADP-рибозилирование) белков, связанных с ДНК. Донором ADP-рибозы является NAD+. Активность PARP возрастает в 500 раз и более при связывании с участками разрыва ДНК. Апоптотическая гибель клетки сопровождается расщеплением PARP каспазами. Чрезмерная активация PARP при массированных разрывах ДНК, сильно снижая содержание внутриклеточного NAD+, ведет к подавлению гликолиза и митохондриального дыхания и вызывает гибель клетки по варианту некроза.
Митохондриальный путь

В клетках, подвергшихся воздействию индуктора апоптоза, резко снижается мембранный потенциал (Dy) митохондрий. Падение Dy обусловлено увеличением проницаемости внутренней мембраны митохондрий вследствие образования гигантских пор. Разнообразны факторы, вызывающие раскрытие пор. К ним относятся истощение клеток восстановленным глутатионом, NAD(P)H, ATP и ADP, образование активных форм кислорода, разобщение окислительного фосфорилирования протонофорными соединениями, увеличение содержания Ca2+ в цитоплазме. Образование пор в митохондриях можно вызвать церамидом, NO, каспазами, амфипатическими пептидами, жирными кислотами. Поры имеют диаметр 2,9 нм, позволяющий пересекать мембрану веществам с молекулярной массой 1,5 кДа и ниже. Следствием раскрытия поры является набухание митохондриального матрикса, разрыв наружной мембраны митохондрий и высвобождение растворимых белков межмембранного объема. Среди этих белков – ряд апоптогенных факторов: цитохром С, прокаспазы 2, 3 и 9 , белок AIF (apoptosis inducing factor), представляющий собой флавопротеин с молекулярной массой 57 кДа.
Образование гигантских пор не является единственным механизмом выхода межмембранных белков митохондрий в цитоплазму. Предполагается, что разрыв наружной мембраны митохондрий может быть вызван гиперполяризацией (переход заряда в отрицательную область) внутренней мембраны. Возможен и альтернативный механизм, без разрыва мембраны, – раскрытие гигантского белкового канала в самой наружной мембране, способного пропускать цитохром С и другие белки из межмембранного пространства.
Высвобождаемый из митохондрий цитохром с вместе с цитоплазматическим фактором APAF-1 (apoptosis protease activating factor-1) участвует в активации каспазы-9 .
APAF-1 – белок с молекулярной массой 130 кДа, содержащий CARD-домен (caspase activation and recruitment domain) образует комплекс с прокаспазой-9 в присутствии цитохрома с и dATP или АТР. Из этих субъединиц собираются жесткие, симметричные структуры, наподобие веера или пропеллера.APAF-1 играет роль арматуры, на которой происходит аутокаталитический процессинг каспазы-9 . Предполагается, что в результате зависимого от гидролиза dATP (или АТР) конформационного изменения APAF-1 приобретает способность связывать цитохром С. Связав цитохром с, APAF-1 претерпевает дальнейшее конформационное изменение, способствующее его олигомеризации и открывающее доступ CARD-домена APAF-1 для прокаспазы-9, которая тоже содержит CARD-домен. Так образуется конструкция, называемая тоже апоптосомой, с молекулярной массой > 1,3 млн дальтон, в составе которой – не менее 8 субъединиц APAF-1 . Благодаря гомофильному CARD-CARD-взаимодействию с APAF-1 в эквимолярном соотношении связывается прокаспаза-9, а затем прокаспаза-9 связывает прокаспазу-3. Пространственное сближение молекул прокаспазы-9 на мультимерной арматуре из APAF-1-цитохром-с-комплексов, по-видимому, приводит к межмолекулярному протеолитическому процессингу (модификации) прокаспазы-9 с образованием активной каспазы-9. Зрелая каспаза-9 затем расщепляет и активирует прокаспазу-3.
Флавопротеин AIF, будучи добавленным к изолированным ядрам из клеток HeLa, вызывает конденсацию хроматина и фрагментацию ДНК, а при добавлении к изолированным митохондриям печени крыс – высвобождение цитохрома с и каспазы- AIF является митохондриальным эффектором гибели клеток у животных, действующим независимо от каспаз.
Кроме рассмотренных компонентов, при нарушении наружной мембраны митохондрий из межмембранного объема выделяется термолабильный фактор, вызывающий необратимое превращение ксантиндегидрогеназы в ксантиноксидазу. Ксантиндегидрогеназа катализирует зависимое от NAD+ окисление ксантина до гипоксантина и последующее окисление гипоксантина до мочевой кислоты. Ксантиноксидаза катализирует те же реакции, но не с NAD+, а с О2 в качестве акцептора электронов. При этом образуются О2A, Н2О2, а из них – и другие активные формы кислорода (АФК), которые разрушают митохондрии и являются мощными индукторами апоптоза. Механизмы образования АФК, конечно, не ограничиваются ксантиноксидазной реакцией. Главным источником АФК в клетках являются митохондрии. Резкое увеличение АФК происходит при возрастании мембранного потенциала в митохондриях, когда снижено потребление ATP и скорость дыхания лимитируется ADP . Цитоплазматическая мембрана макрофагов и нейтрофилов содержит О2A – генерирующую NADPH-оксидазу.
В зависимости от пути, по которому осуществляется активация каспаз, различают разные типы клеток. Клетки типа I (в частности, линия лимфобластоидных В-клеток SKW и T-клетки линии Н9) подвергаются ПКС по пути, зависимому от апоптозных рецепторов плазматической мембраны без участия митохондриальных белков. Клетки типа II (например, линии Т-клеток Jurkat и СЕМ) погибают по пути апоптоза, зависимому от митохондриального цитохрома С. Гибель клеток, вызванная химиотерапевтическими соединениями, УФ- или і-облучением, по-видимому, напрямую связана с апоптозной функцией митохондрий.
Некоторые клетки, например, клетки эмбриональной нервной системы, включают механизмы апоптоза, если они испытывают дефицит апоптозподавляющих сигналов (называемых также факторами выживания) от других клеток. Физиологический смысл процесса – в элиминации избыточных нервных клеток, конкурирующих за ограниченный фонд факторов выживания. Эпителиальные клетки при отделении от внеклеточного матрикса, вырабатывающего факторы выживания, тоже обречены на смерть. Факторы выживания связываются соответствующими цитоплазматическими рецепторами, активируя синтез подавляющих апоптоз агентов и блокируя стимуляторы апоптоза. Некоторые вещества (например, стероидные гормоны) оказывают дифференцированный эффект на различные типы клеток – предотвращают апоптоз одних типов клеток и индуцируют его у других. Так, при наличии во внеклеточном матриксе факторов роста PDGF (platelet-derived growth factor – тромбоцитарный фактор роста) или NGF (nerve growth factor – фактор роста нервов) и цитокина интерлейкина-3 (IL-3) проапоптозный белок Bad не активен.Факторы роста, связавшись со своим рецептором на плазматической мембране, вызывают активацию цитозольной протеинкиназы В, и катализирующей фосфорилирование Bad по Ser-136. IL-3 тоже связывается со своим рецептором на плазматической мембране и активирует митохондриальную cAMP-зависимую протеинкиназу А, катализирующую фосфорилирование Bad по Ser-112. Будучи фосфорилированным по обоим остаткам серина, Bad образует комплекс с белком 14-3-3, располагающийся в цитоплазме. Дефицит факторов роста и IL-3 воспринимается клеткой как сигнал к апоптозу: происходит дефосфорилирование Bad, его внедрение в наружную мембрану митохондрий, выход цитохрома с из митохондрий и последующая активация каспазы-9 через APAF-1-зависимый механизм.
Другие пути
В ряде случаев апоптоз реализуется в результате комбинированного действия двух путей – с участием и рецепторов плазматической мембраны, и митохондриального цитохрома C. Так, повреждение ДНК ведет к накоплению в клетке белкового продукта гена р53, который может останавливать деление клеток и/или индуцировать апоптоз.
Белок р53 является фактором транскрипции, регулирующим активность ряда генов. Предполагается, что ответная реакция на образование белка р53 зависит от степени нарушения клеточного генома. При умеренном нарушении генома происходит остановка клеточного деления, осуществляется репарация ДНК, и клетка продолжает свое существование. При чрезмерном нарушении генома, когда ДНК уже не поддается репарации, включаются рецепторный и цитохром С-зависимый апоптозные каскады активации каспаз.
Также Существует путь передачи летального сигнала с участием эндоплазматического ретикулума (ЭР) . В ЭР локализована прокаспаза-12. Нарушение внутриклеточного Ca2+-гомеостаза добавкой тапсигаргина или Ca2+-ионофорного антибиотика А23187 ведет к апоптозу клеток, вызванному превращением прокаспазы-12 в каспазу-12. ЭР-зависимый апоптоз связан с болезнью Альцгеймера.
Цитотоксические лимфоциты, Т-киллеры, могут вызывать апоптоз у инфицированных клеток с помощью белка перфорина. Полимеризуясь, перфорин образует в цитоплазматической мембране клетки-мишени трансмембранные каналы, по которым внутрь клетки поступают TNFb , гранзимы (фрагментины) – смесь сериновых протеаз. Существенным компонентом этой смеси является гранзим В – протеолитический фермент, превращающий прокаспазу-3 в активную каспазу-3.
Взаимодействие клеток с внеклеточным матриксом осуществляется с помощью интегринов. Интегрины – большое семейство гетеродимерных мембранных белков, которые участвуют в адгезии клеток, связывая внутриклеточный цитоскелет с лигандами внеклеточного матрикса. Нарушение адгезии клеток индуцирует апоптоз.
Особую форму апоптоза претерпевают эритроциты млекопитающих. Биогенез эритроцитов из плюрипотентной в костном мозге включает ряд промежуточных этапов. На этапе эритробласта ядро изгоняется (выталкивается) из клетки и пожирается макрофагом. Альтернативный вариант: кариорексис (деструкция ядра) с образованием телец Жолли (остатки хроматина) и их последующий распад и лизис внутри клетки. Безъядерная клетка, называемая ретикулоцитом, в дальнейшем теряет митохондрии и рибосомы и превращается в эритроцит. Потерю ядра эритробластом можно рассматривать как особую форму ядерного апоптоза. Выяснение его механизма позволило бы применить его для обезвреживания опухолевых клеток.
Второй этап- активация генов...а затем конец
 На втором этапе запрограммированной смерти клеток внутриклеточные регуляторы, получив важные инструкции, вносят поправки в работу отдельных генов. Работа эта, как известно, заключается в образовании РНК, а затем и белков. Таким образом, в результате срабатывания генетической программы, первоначально запущенной сигналом с рецептора, происходит изменение набора внутриклеточных РНК и белков. В конечном счете появляются или активируются ферменты - протеазы и нуклеазы.
На втором этапе запрограммированной смерти клеток внутриклеточные регуляторы, получив важные инструкции, вносят поправки в работу отдельных генов. Работа эта, как известно, заключается в образовании РНК, а затем и белков. Таким образом, в результате срабатывания генетической программы, первоначально запущенной сигналом с рецептора, происходит изменение набора внутриклеточных РНК и белков. В конечном счете появляются или активируются ферменты - протеазы и нуклеазы.
Ферменты расщепляют содержимое клетки, которое затем поглощается фагоцитами.
Апоптоз и старение
 Известный американский ученый Л.Хейфлик в Медицинском центре детской больницы Северной Каролины впервые доказал, что естественная продолжительность жизни человека обусловлена числом митозов , которое могут совершить клетки данного организма. Он брал кусочки кожи от эмбриона, новорожденного и взрослого человека, разбивал их на отдельные клетки и культивировал в специальной питательной среде. Оказалось, что клетки эмбриона могут совершить около 50 делений, а затем в них наблюдаются все признаки апоптотической смерти. У взрослого человека клетки могли совершить уже не 50 а гораздо меньше делений, в зависимости от возраста обследуемого пациента. Впоследствии было показано,что механизм старческого апоптоза запускается и находиться в ядре.
Известный американский ученый Л.Хейфлик в Медицинском центре детской больницы Северной Каролины впервые доказал, что естественная продолжительность жизни человека обусловлена числом митозов , которое могут совершить клетки данного организма. Он брал кусочки кожи от эмбриона, новорожденного и взрослого человека, разбивал их на отдельные клетки и культивировал в специальной питательной среде. Оказалось, что клетки эмбриона могут совершить около 50 делений, а затем в них наблюдаются все признаки апоптотической смерти. У взрослого человека клетки могли совершить уже не 50 а гораздо меньше делений, в зависимости от возраста обследуемого пациента. Впоследствии было показано,что механизм старческого апоптоза запускается и находиться в ядре.
В настоящее время для объяснения молекулярно-генетических механизмов старения организма предложено три гипотезы.
1. Первая гипотеза особенно отчетливо развита в трудах профессора Ж. Медведева, а также Л. Орджелом  из Института им. Солка в США. Эти исследователи считают, что старение это процесс накопления ошибок в процессах транскрипции и трансляции и возникновении ферментов с дефектным функционированием. При этом механизмы репарации не могут справится со все возрастающим количеством дефектов.
из Института им. Солка в США. Эти исследователи считают, что старение это процесс накопления ошибок в процессах транскрипции и трансляции и возникновении ферментов с дефектным функционированием. При этом механизмы репарации не могут справится со все возрастающим количеством дефектов.
2. Согласно второй гипотезе, предложенной также Ж.Медведевым 0,4% информации содержащейся в ДНК клеточного ядра, используется клеткой постоянно на протяжении ее жизни. Кроме того, многие гены в молекуле ДНК повторяются, делая генетическую информацию в высокой степени избыточной. Ж. Медведев предположил, что повторяющиеся последовательности обычно репрессированы, но в случае значительного повреждения активного гена он заменяется одним из идентичных резервных генов. Избыточность ДНК может, следовательно, служить гарантией против внутренне присущей подверженности системы случайным молекулярным повреждениям. Однако постепенно весь резерв генов будет исчерпан и тогда начинают возникать патофизиологические изменения, которые приведут к гибели клетки. Таким образом чем больше избыточной ДНК, тем больше продолжительность жизни данного вида.
3. Третья гипотеза постулирует, что возрастные изменения представляют собой продолжение нормальных генетических сигналов, регулирующих развитие животного от момента его зачатия до полового созревания. Быть может даже есть "гены старения" которые замедляют или даже закрывают биохимические пути один за другим и ведут к предсказуемым возрастным изменениям. При этом снижаются функциональные возможности клеток. Старение организма - это по существу старение и апоптоз ключевых клеток, гибель которых способна повлиять на физиологию всего организма.
В процессе старения происходит постоянное уменьшение числа неделящихся клеток, например нейронов. Согласно одной из теорий старения, в организме происходит накопление "поломок" - поломки ДНК, накопление токсических продуктов и т.д. В результате этого клетки гибнут.
В 1982 году С.Р. Уманский предложил гипотезу, согласно которой старение может быть следствием плейотропного эффекта группы генов, несущих информацию о программированной гибели клетки (апоптозе). С одной стороны, эта программа необходима для развития и функционирования многоклеточного организма. Вместе с тем она делает неизбежной гибель клеток у взрослого организма. В таком случае старение является следствием постепенной убыли функционально активных клеток (Уманский, 1982). До сих пор идут дискуссии о роли апоптоза в процессе старения. Часть исследователей во главе с академиком Скулачевым являются сторонниками теории клеточного апоптоза. Старение, с точки зрения Скулачева, – результат того, что в организме гибнет больше клеток, чем рождается, а отмирающие функциональные клетки заменяются соединительной тканью. Суть его работы – поиск методов противодействия разрушению клеточных структур свободными радикалами. По мнению ученого, старость – это болезнь, которую можно и нужно лечить, программу старения организма можно вывести из строя и тем самым выключить механизм, сокращающий нашу жизнь.
До сих пор идут дискуссии о роли апоптоза в процессе старения. Часть исследователей во главе с академиком Скулачевым являются сторонниками теории клеточного апоптоза. Старение, с точки зрения Скулачева, – результат того, что в организме гибнет больше клеток, чем рождается, а отмирающие функциональные клетки заменяются соединительной тканью. Суть его работы – поиск методов противодействия разрушению клеточных структур свободными радикалами. По мнению ученого, старость – это болезнь, которую можно и нужно лечить, программу старения организма можно вывести из строя и тем самым выключить механизм, сокращающий нашу жизнь.
Некоторые ученые, например, Бойко, критикуют теорию Скулачева . В частности сам Бойко является автором .
Исследования и перспективы
 Как упоминалось выше, сейчас по всему миру идут интенсивные исследования апоптоза.В основном это связано с онкологией- индукция апоптоза раковых клеток. Но этим все не ограничивается. В настоящее время идет разработка методов подавления возрастзависимого апоптоза в постмитотических и слабопролиферирующих тканях.
Как упоминалось выше, сейчас по всему миру идут интенсивные исследования апоптоза.В основном это связано с онкологией- индукция апоптоза раковых клеток. Но этим все не ограничивается. В настоящее время идет разработка методов подавления возрастзависимого апоптоза в постмитотических и слабопролиферирующих тканях.
На первом месте среди причин смерти в большинстве стран стоят сердечно-сосудистые заболевания. Практически все пожилые люди страдают ими. Сердечная недостаточность, являющаяся конечным этапом сердечно-сосудистых заболеваний, приводит к недостаточному кровоснабжению органов, патологическим изменениям в них, т.е. в конечном итоге- к ускорению процесса износа организма- к ускорению процесса старения. При ишемии миокарда и его последующей реперфузии кардиомиоциты гибнут апоптозом. Китайские ученые Lv X, Wan J, Yang J, Cheng H, Li Y, Ao Y, Peng R провели исследование, в результате которого было определено, что селективные ингибиторы цитохром P450-омега гидроксилазы, которая индуцирует апоптоз кардиомиоцитов, снижают гибель кардиомиоцитов после ишемии и последующей реперфузии. Подобные исследования были проведены в отношении DIDS (4,4"-диизотиоцианостильбен-2,2"-дисульфоновая кислота), который снижает Staurosporine-индуцируемый апоптоз кардиомиоцитов, проходящий через PI3K/Akt- сигнальный путь апоптоза, с помощью активации NO-синтазы и подавления транслокации BAX.
Также проводились исследования на клетках эндотелия (эндотелий- выстилка сосудов) в условиях гипоксии и гиперхолестеринемии (повышенного содержания холестерина в крови), нейронах , хондроцитах и т.д. Т.е. в условиях, близких к возрастным изменениям в человеческом организме- ишемическая болезнь сердца, заболевания нервной системы и опорно- двигательного аппарата. Необходимо расширить изучение этой проблемы, перейти от экспериментов на животных к исследованиям на людях, т.к. перспективы этого направления исследований огромны- это возможность продлить жизнь, продлить активные годы, улучшить качество жизни.
Другой задачей для ученых должно стать исследование возможности индукции апоптоза нерепарирующихся клеток на ранних стадиях развития совместно с компенсаторной пролиферацией для замедления последующего старения тканей. (Москалев, 2007)
Необходимо переходить от дрозофил к людям, от изучения механизмов к практическим разработкам в целях борьбы со старением.
Существуют два хорошо охарактеризованных пути апоптоза: с участием рецепторов клеточной гибели (внешний путь) и с участием митохондрий (собственный путь)
Активация каспаз и апоптоз индуцируются связыванием специфических лигандов из группы TNF со своими рецепторами (рецепторы клеточной гибели)
У позвоночных активация каспаз происходит при различных путях . На рисунке ниже представлены два хорошо известных пути. Это путь с участием рецепторов клеточной гибели (который также называется внешний путь) и путь с участием митохондрий (собственный путь). Хотя между обоими путями имеется несколько существенных различий, они обладают чертой сходства, котороая заключается в том, что каждый включает этап активации инициирующей каспазы по механизму индуцированного сближения с последующей активацией эффекторных каспаз.
Вместе с тем, наблюдается некоторый перекрест между двумя механизмами , поскольку путь с участием рецепторов клеточной гибели может включать элементы митохондриального пути.
Представляют собой подгруппу относящихся к семейству рецепторов фактора некроза опухоли (TNFR) позвоночных. Они включают TNFR1, Fas (также называемый CD95 или АРО-1) и TRAIL (TRAIL-R1, -R2 у человека, также называемые DR4 и DR5). На рисунке ниже представлены различные типы рецепторов клеточной гибели.
Эти тримерные рецепторы связываются со специфическими лигандами (TNF, Fas-лигандом или TRAIL соответственно) и могут быстро запускать в клетках процесс апоптоза. Лиганды продуцируются различными клетками, включая клетки иммунной системы, часто в ответ на факторы, вызывающие воспаление.
Рецепторы гибели клеток содержат домен смерти, расположенный внутри клетки. Эти домены, как и домены CARD, DED и PYR, представляют собой еще один пример складок смерти, и они взаимодействуют с доменами смерти в адаптерных молекулах.
Находятся на поверхности клеток в виде тримеров, и, вероятно, соответствующие лиганды располагаются в виде кластеров, которые связаны с двумя и более этих тримеров. Такое расположение делает рецепторы доступными для взаимодействия с внутриклеточными белками. После связывания между собой доменов гибели Fas/CD95 и рецепторов TRAIL, они ассоциируют с адаптерным белком FADD (Fas-associated death domain). Эта ассоциация возникает при участии домена гибели FADD белка.
При этом в клетке молекулы FADD сближаются, и становится доступным другой регион белка, содержащий DED.
Домен DED белка FADD теперь связывается с DED-участками продомена мономера каспазы-8, что приводит к образованию димеров и активации инициаторной каспазы по механизму индуцированного сближения. После связывания рецептора гибели быстро образуется комплекс, содержащий FADD (за счет взаимодействия с доменом гибели). FADD связан с каспазой-8 (за счет взаимодействия с DED). Это сигнальный комплекс, индуцирующий клеточную гибель (англ, death-inducing signaling complex, DISC).
Активированная каспаза-8 начинает расщеплять в клетке субстраты, включая эффекторные каспазы-3 и -7, и происходит апоптоз. На рисунке ниже представлена последовательность событий при развитии апоптоза с участием рецепторов клеточной гибели.
Известно много примеров апоптоза , происходящего с участием рецепторов клеточной гибели. Этот путь особенно характерен для функционирования эффекторов иммунной системы и для регуляции иммунных процессов. Внешний путь апоптоза также реализуется в клетках другого происхождения, включая нейроны. В настоящее время в качестве возможного противоопухолевого средства исследуется TRAIL, который обладает способностью индуцировать апоптоз в клетках некоторых опухолей.
В соответствии с установленной ролью Fas в иммунной системе у людей, а также у мышей, несущих мутации, затрагивающие Fas или его лиганд, наблюдается заболевание, при котором происходит массивное разрастание лимфатических органов. Это разрастание обусловлено накоплением измененной популяции Т-клеток. У больных также отмечаются аномалии В-лимфоцитов, включающие продуцирование аутоиммунных антител и развитие В-клеточных лимфом.
Представлены два пути реализации апоптоза у позвоночных.Путь через рецепторы клеточной гибели (также носящий название внешний путь) запускается, когда специфические лиганды гибели, относящиеся к семейству TNF, находят свои рецепторы.
Митохондриальный путь (также называемый внутренним, или собственным, путем)
реализуется при нарушении проницаемости наружной мембраны митохондрий в результате взаимодействий белков семейства Bcl-2 и высвобождения межмембранных белков.
К числу последних относится цитохром С, который при взаимодействии с белками цитозоля запускает активацию каспаз.
Эти процессы подробно рассмотрены в последующих статьях на сайте.
 Рецепторы клеточной гибели относятся к семейству TNF-рецепторов,
Рецепторы клеточной гибели относятся к семейству TNF-рецепторов,
у которых со стороны клетки расположены домены клеточной гибели.
На поверхности многих типов клеток позвоночных эти рецепторы существуют в виде тримеров.
 При связывании лиганда с рецептором клеточной гибели на поверхности клетки, адаптерный белок FADD присоединяется к нему с клеточной стороны.
При связывании лиганда с рецептором клеточной гибели на поверхности клетки, адаптерный белок FADD присоединяется к нему с клеточной стороны.
Это происходит при взаимодействии доменов клеточной гибели (DD)-(DD).
Затем при участии эффекторных доменов клеточной гибели (DED)-(DED) к белку FADD присоединяется каспаза-8.
При димеризации каспазы-8 фермент активируется по механизму индуцированной близости.
Активная каспаза расщепляет и активирует эффекторные каспазы, которые вызывают апоптоз.
Комплекс, содержащий рецептор клеточной гибели, FADD и каспазу-8, называется сигнальным комплексом индукции клеточной гибели (DISC).